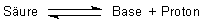
Der Säure/Base-Begriff nach Brönsted
Im Jahr 1923 setzte unabhängig voneinander durch Lowry in Cambridge und Brønsted (deutsche Schreibweise Brönsted) in Kopenhagen die moderne Entwicklung des Säure/Base-Begriffs ein. Zunächst beschäftigte sich der Begriff ausschließlich mit dem System Wasser. Brönsted erweiterte ihn aber anschließend auf Säure/Base-Reaktionen in nichtwässrigen Lösungsmitteln.
Protonendonatoren und -akzeptoren
Nach Brönsted sind Säuren Verbindungen, die Protonen abgeben können
(Protonendonatoren), und Basen Verbindungen, die Protonen
aufnehmen können (Protonenakzeptoren). Die Definition von Säuren und Basen
lässt sich somit auf folgendes Gleichgewicht reduzieren:
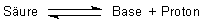
Nehmen wir das Beispiel der Essigsäure (CH3COOH) in Wasser (H2O).
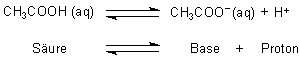
Da aber ein Proton extrem reaktiv ist, liegt es nicht so "nackt" vor, sondern bindet sich ans Wassermolekül:
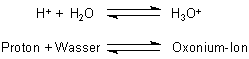
(Auch dieses ist ein Beispiel für die Brönstedsche Säure/Base-Theorie!)
Somit muss die ganze Reaktionsgleichung so heißen:
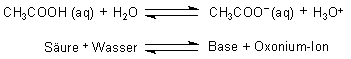
Bei diesem Beispiel gibt also die Essigsäure ein Proton an das Wasser ab, das in diesem Fall als Base funktioniert und somit ein Proton aufnimmt und zum Oxonium-Ion (H3O+) wird.
Einmal Säure - immer Säure?
Bei dieser Reaktion stellt sich ein Gleichgewicht ein. Somit haben wir eigentlich zwei Säuren
und zwei Basen:
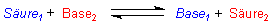
Bleiben wir beim Beispiel des Lösens der Essigsäure in Wasser, so sieht die Reaktion folgendermaßen aus:
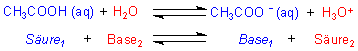
Bei der Hinreaktion gibt die Säure Essigsäure ein Proton an die Base Wasser ab. Dadurch wird das entstandene Acetat-Ion (CH3COO-) zur Base und das Wasser zum Oxonium-Ion bzw. zur Säure. Bei der Rückreaktion gibt das Oxonium-Ion ein Proton an das Acetat-Ion ab, wodurch wieder Essigsäure und Wasser entstehen.
Paare wie CH3COOH und CH3COO- ebenso wie H2O und H3O+ werden jeweils als konjugiertes Säure/Base-Paar bezeichnet, da sie durch Aufnahme bzw. Verlust eines Protons zusammengehören. Die gleich bezifferten (gleich farbigen) Moleküle der Reaktionsgleichung stellen somit je ein solches korrespondierendes Säure/Base-Paar dar.
Anders ausgedrückt kann man auch sagen:
H2O ist die konjugierte Base zu H3O+
H3O+ ist die konjugierte Säure zu H2O
CH3COO- ist die konjugierte Base zu CH3COOH
CH3COOH ist die konjugierte Säure zu CH3COO-
Je stärker eine Säure ist, desto schwächer ist ihre korrespondierende Base. Dann ist die Tendenz zur Rückbildung der Säure nicht gegeben. Ein Beispiel ist die Salzsäure. Ihre Base ist das Chlorid-Ion. Das ist so schwach, dass wir hier kein Säure/Base-Gleichgewicht vorliegen haben; d. h., dass die Säure HCl vollständig dissoziiert ist und bleibt.
HCl + H2O ———> Cl- + H3O+
Säure oder Base?
Zudem gibt es noch viele Moleküle und Ionen, die sowohl als Basen wie auch als Säuren auftreten
können.
Bei der Schwefelsäure haben wir zwei Dissoziationsstufen, die durch eine starke und eine schwache Säure charakterisiert sind:
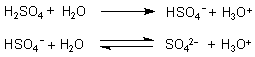
Wir sehen, dass das HSO4--Ion zugleich Base (in der ersten Reaktion) und Säure (in der zweiten Reaktion) ist. Einen solchen Stoff nennt man Ampholyt; seine Eigenschaft heißt amphoter.
Wasser ist ebenfalls ein Ampholyt. In der Reaktion mit Essigsäure ist es Base (s. o.), wohingegen es in der Reaktion mit Ammoniak als Säure auftritt:
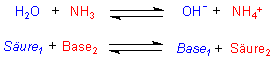
Gerade beim Ammoniaksystem hat sich die Brönstedsche Säure/Base-Theorie bewährt. Das gilt auch für Ammoniak als Säure:
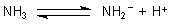
Das Anion ist eine bemerkenswert starke Base; es heißt Amid-Ion.
Die folgende Tabelle fasst Beispiele für amphotere Stoffe zusammen:
| Korrespondierende Säure/Base-Paare | ||
| Ampholyt | Säure | Base |
| H2O | H2O
H3O+ |
OH-
H2O |
| NH3 | NH3
NH4+ |
NH2-
NH3 |
| HSO4- | HSO4-
H2SO4 |
SO42-
HSO4- |
| HPO42- | HPO42-
H2PO4- |
PO43-
HPO42- |
Weitere Texte zum Thema „Ammoniak, Amine und Säure-Amide“