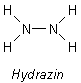
Hydrazin - Das dimere Ammoniak
Hydrazin ("Diazan") kann man als Dimeres des Ammoniaks auffassen. Man kann auch von Homologen sprechen - wie beim Paar Methan und Ethan.

So wird es auch durch Oxidation von Ammoniak gewonnen. Oxidationsmittel ist Hypochlorit:
(1) 2 NH3 + ClO- ———> N2H4 + H2O + Cl-
Beim Hydrazin handelt es sich bei Raumtemperatur um eine farblose, ölige, an der Luft stark rauchende Flüssigkeit. Mit Säuren bildet es Salze wie z. B. Hydrazinsulfat:
(2) [N2H6]2+SO42-
Die Gefahren beim Umgang mit Hydrazin
Hydrazin ist nicht ganz leicht zu handhaben.
Hydrazin und seine Dämpfe sind giftig und können Krebs erzeugen. Allerdings lässt es sich an seinem Ammoniak-ähnlichen Geruch sehr leicht erkennen. Zudem wirkt Hydrazin stark haut- und schleimhautreizend.
Steigt die Temperatur über 250 °C, so zerfällt Hydrazin explosionsartig in Stickstoff und Ammoniak.
(3) 3 H2N-NH2 ———> 4 NH3 + N2
Diese Reaktion kann auch durch Katalysatoren gefördert werden. Sie ist Grundlage für den Einsatz als Treibstoff für Raketen (siehe unten).
Eine weitere Gefahr birgt die Selbstentzündung von Hydrazin-Luft-Gemischen mit einem Hydrazin-Gehalt von mehr als 5 Vol% bei einer Temperatur von über 50 °C.
Hydrazin als Treibstoff
Wasserfreies Hydrazin und seine Derivate eignen sich durch ihre hohe Verbrennungswärme als
Raketentreibstoff. Sie gehören zu der Gruppe der Monergole (Einfachtreibstoffe).
So nennt man feste oder flüssige, einheitliche Substanzen wie Hydrazin oder Substanzgemische, deren Zersetzung
zu energiereichen Produkten durch Temperaturerhöhung oder Katalysatoreinfluss in Gang gesetzt wird.
Diese Eigenschaft haben wir beim Hydrazin gefunden.
Die Leistung dieser Monergole ist relativ gering. Daher werden sie meistens nur zum Antrieb von Hilfsaggregaten verwendet.
Eine der berühmtesten Anwendung als Raketentreibstoff fand Hydrazin zusammen mit einem seiner Derivate (Dimethylhydrazin (H3C)2N-NH2) im Antrieb des Apollo-Mondfahrzeugs.
Aber auch moderne Raketen können mit Mischungen aus Hydrazin N2H4 und Salpetersäure HNO3 oder Distickstofftetraoxid N2O4 angetrieben werden.
(4) 5 N2H4 (l) + 4 HNO3 (l) ———> 7 N2 (g) + 12 H2O (l) + Energie
Hydrazin in Brennstoffzellen
Die ersten Brennstoffzellen wurden u. a. mit Hydrazin
als Brennstoff betrieben. Das liegt u. a. daran, dass Hydrazin stark reduzierend wirkt.
(5) N2H4 ———> N2 + 4 H+ + 4 e-
Besonders in alkalischem Milieu macht sich seine Reduktionskraft bemerkbar (E0 = -1,26 V). Heute verzichtet man auf Hydrazin - aus toxikologischen Gründen.
Weitere Texte zum Thema „Ammoniak, Amine und Säure-Amide“