
Einleitung zur Webseitengruppe „Oxalsäure“

Bild 1: Sauerklee
(Foto: Blume)
Jeder kennt sauer schmeckende Pflanzen. Früher hat wohl jedes Kind schon einmal auf der Wiese
gelegen und Sauerampfer (Rumex acetosa) gekaut. Oder im Wald Sauerkleeblätter
(Oxalis acetosella) genascht. Da war auch noch das leckere Rhabarberkompott –
unerlässlich für einen heißen Sommertag!
Allen gemeinsam ist eine Säure: Die Oxalsäure. Sie hat ihren Namen von der wissenschaftlichen Bezeichnung des Sauerklees: Oxalis acetosella. Die Oxalsäure hieß früher auch Kleesäure.
Die Struktur der Oxalsäure hat interessante Stoffeigenschaften zur Folge, die man im Unterricht im Rahmen eines Projekts erarbeiten kann. An der Oxalsäure kann man vieles über die Prinzipien der gesamten Chemie lernen.
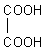
Strukturformel der Oxalsäure
Oxalsäure ist die einfachste Dicarbonsäure, die Ethandisäure. Sie war zudem eine der ersten bekannten Säuren. Ihre Kalium-Salze wurden bereits 1769 beschrieben. Bemerkenswert ist zudem, dass Wöhler sie bereits 1824 aus Dicyan (CN)2 herstellte.
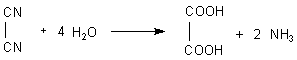
Wöhlers Oxalsäuresynthese (1824)
Somit ist dies seine erste Synthese eines biologischen Stoffs aus rein anorganischen Substanzen – und nicht seine immer wieder zitierte Synthese des Harnstoffs, die erst 1828 erfolgte.
Zurück zum Anfang: Das Naschen saurer Pflanzen ist aber gesundheitlich gar nicht so gut! Wie wir heute wissen, ist die Oxalsäure giftig oder zumindest toxikologisch bedenklich. Schon aus diesem Grunde sollte man etwas mehr darüber wissen.
Wussten Sie Folgendes?
Noch im 19. Jahrhundert wurde Oxalsäure als Säuerungsmittel für Limonaden und andere Erfrischungsgetränke
genutzt, was von medizinischer Seite sogar ausdrücklich als unbedenklich empfohlen wurde…
Warum nahm man nicht Citronensäure, die bekanntlich im
menschlichen Organismus eine wichtige Rolle spielt und deshalb problemlos abgebaut wird?
Citronensäure war teuer, denn sie musste buchstäblich aus Zitronen gewonnen werden. Waren die Zitronen
schon teuer genug, galt das erst recht für die Citronensäure.
Deshalb lag es nahe, statt der Citronensäure Oxalsäure zu nehmen. Denn die konnte man billig aus vielen in Mitteleuropa heimischen Pflanzen gewinnen.
Und wussten Sie, dass es auch gelbblütigen Sauerklee gibt? Der bereichert heute viele naturbelassene Gärten als Wildkraut, galt früher aber als Zierpflanze. Er gehört zu den so genannten „Neophyten“, also zu den primär hier nicht heimischen Pflanzen, die nach 1500 durch menschlichen Einfluss aus fernen Ländern zu uns gekommen sind.

Bild 2: Aufrechter Sauerklee (Oxalis stricta)
(Foto: Blume)
Von den gelben Sauerkleearten gibt es in unseren Gärten auch eine kriechende Form.

Bild 3: Hornfrüchtiger Sauerklee (Oxalis corniculata)
(Foto: Blume)
Bekannt sind jedem sicherlich auch die vierblättrigen Oxalis-Formen wie Oxalis deppei, die als
„Glücksklee“ zu Silvester verkauft werden.
Weitere Texte zum Thema "Oxalsäure"