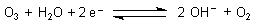
Ozon ist ein starkes Oxidationsmittel
Experimente:
Versuch: Oxidationswirkung von Ozon auf anorganische Substanzen
Versuch: Enteisenen von Mineralwasser durch Ozon
Versuch: Oxidation von Quecksilber
Die direkte chemische Wirkung des Schadgases Ozon beruht auf seiner starken Oxidationskraft.
Ozon überträgt Sauerstoffatome
Es erweist sich dabei einmal als ein Transportsystem für hochreaktive Sauerstoffatome. Formal gilt:
O3 ———> O2 + O
Diese Oxidationswirkung kann man gut mit anorganischen Verbindungen zeigen. Beispielsweise oxidiert Ozon braunschwarzes Blei(II)-sulfid zu farblosem Blei(II)-sulfat (siehe Experimente, V 2).
Ozon kann deshalb Bilder, die mit sulfidischen Pigmenten gemalt sind, angreifen.
Auch edlere Metalle werden von Ozon angegriffen. Ein Beispiel ist das Quecksilber, das unter Einwirkung von Ozon seine Benetzungseigenschaften ändert. Grund hierfür ist ein feiner Oxidüberzug (siehe Experimente, V 4).
Hg + O3 ———> HgO + O2
Genau genommen ist Ozon ein Elektronenakzeptor
Ozon reagiert aber auch ohne Sauerstoffübertragung. Dann ist es zusammen mit dem Wassersystem nur ein
Elektronenakzeptor.
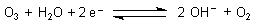
Hierauf beruht zum Beispiel der Nachweis des Ozons mit dem Schönbeinfilter.
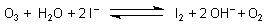
Ein anderes Beispiel ist das Hexacyanoferrat(II)-Ion (siehe Experimente, V 2).
2 [Fe(CN)6]4¯ + O3 + H2O ———> 2 [Fe(CN)6]3¯ + O2 + 2 OH¯
Natürlich ist auch der oben angesprochene Sauerstofftransfer letztlich eine Elektronenübertragungsreaktion, bei der das Ozon als Elektronenakzeptor dient:
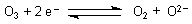
Das Sauerstoff-Anion reagiert mit dem Elektronendonator. In den obigen Beispielen waren das das Sulfid-Ion sowie das Quecksilbermetall.
Technische Anwendungen des Sauerstofftransfers
Den Sauerstofftransfer durch Ozon nutzt man übrigens in der Wasseraufbereitungs-Technik aus.
Mangan(II)-Verbindungen werden bereits im neutralen Milieu zu Braunstein oxidiert (siehe Experimente, V 2).
Man kann auf diese Art störende Mangan(II)-Ionen aus Mineralwässern abtrennen.
Ozon überführt auch lösliche Eisen(III)-aqua-Komplexe in rasch ausflockende und daher schnell abtrennbare
Eisen(III)-oxid/hydroxid-Niederschläge wie FeOOH, indem es ohne Änderung von Oxidationszahlen auf Eisen(III)-Ionen
Sauerstoff überträgt. Dies spielt eine wichtige Rolle beim Enteisenen von Mineralwässern. Denn
Eisenverbindungen, die in jedem natürlichen Mineralwasser enthalten sind, stören den Geschmack der Getränke
und trüben sie außerdem. (Beim Enteisenen wird auch der natürliche Gehalt an Manganverbindungen vermindert.)
Am besten funktioniert das Verfahren bei pH 8, also nach Entfernen des Kohlenstoffdioxids. Letzteres
wird während des Abfüllens wieder zugeführt.
Der Versuch 3 zeigt das Prinzip. Er erfordert allerdings ein wenig Fingerspitzengefühl.
Das Standardpotential E0 des Ozons ist vom pH-Wert
der Lösung abhängig
Zum Vergleich zeigen wir hier auch die Werte von Sauerstoff und von Wasserstoffperoxid, die ebenfalls
technisch als Oxidationsmittel genutzt werden.
| Ozon | ||
| pH 0: | 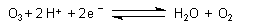 |
E0 = + 2,07 V |
| pH 14: | 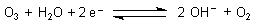 |
E0 = + 1,24 V |
| Sauerstoff | ||
| pH 0: | 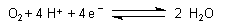 |
E0 = + 1,229 V |
| pH 14: | 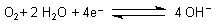 |
E0 = + 0,401 V |
| Wasserstoffperoxid | ||
| pH 0: | 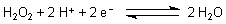 |
E0 = + 1,776 V |
| pH 14: | 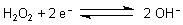 |
E0 = + 0,878 V |
Weitere Texte zum Thema „Ozon“