Für Experten
Was läuft bei der Elektrolyse von Schwefelsäure eigentlich ab?
Üblicherweise spricht man von der Elektrolyse des Wassers.
H2O ———> H2 + O-Atom
Jedoch werden die Moleküle des Wassers nicht direkt zerlegt, sondern die H+- und OH--Ionen werden entladen. Auch das läuft nicht so einfach ab. Grund ist die sehr hohe Aktivierungsenergie vor allem an der Anode. Man sagt auch, dass Sauerstoff (anders als Wasserstoff) eine zu hohe Überspannung gegenüber Platin aufweist.
Wie kommt es dann aber zu einer anodischen Sauerstoffabscheidung, wenn wir verdünnte
Schwefelsäure einsetzen? Das riecht nach Katalyse!
In verdünnter Schwefelsäure werden an der Anode statt der äußerst gering konzentrierten
OH--Ionen des Wassers die Sulfat-Ionen oxidiert und dabei teilweise entladen.
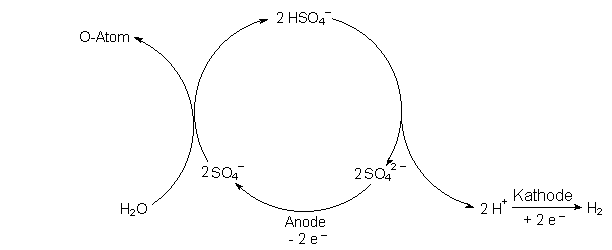
SO42- ———> SO4- + e-
Es entsteht das Schwefelperoxid-Anion SO4-. Dieses reagiert nur bei höheren Sulfat-Konzentrationen zum Anion der Peroxodischwefelsäure H2S2O8.
2 SO4- ———> S2O82-
In verdünnten Schwefelsäurelösungen, wie wir sie verwenden, reagiert SO4- mit Wasser allerdings spontan zu Hydrogensulfat-Anionen HSO4- und Sauerstoff. Die Gesamtreaktion kann man dann so formulieren:
2 SO4- + H2O ———> 2 HSO4- + ½ O2
Die Sulfat-Ionen sind also Katalysatoren. Deshalb können wir die Elektrolyse besser als Kreisprozess formulieren.

Du erkennst, dass letzten Endes ein Wassermolekül zersetzt wird.
H2O ———> H2 + O-Atom
Die an der Anode entstandenen Sauerstoffatome reagieren zunächst zu einem Sauerstoffmolekül. Dieses kann mit einem dritten Atom zu Ozon reagieren:
O2 + O ———> O3
Mit Wassermolekülen können die O-Atome auch Wasserstoffperoxid oder Hydroxylradikale bilden.
O + H2O ———> H2O2
O + H2O ———> 2 OH
Heute kann man mit Hilfe von Kationenaustauscher-Membranen Wasser auch ohne Schwefelsäurezusatz elektrolysieren. Lies hierzu die Webseite Elektrolyse von Reinstwasser mit dem Membranverfahren.
Zur Chemie mit Wasserstoffperoxid haben wir eine große
Webseitengruppe.
Literatur:
Holleman-Wiberg. Lehrbuch der Anorganischen Chemie. Walter de Gruyter, Berlin-New York
1995.
Weitere Texte zum Thema „Ozon“