Bunte Alkoholflammen mit Borsäureestern
Experimente:
Versuch: Borsäureester mit Methanol und Ethanol
Ein beliebtes chemisches Schulexperiment ist der Nachweis der beiden einfachen
Alkohole Methanol und Ethanol aufgrund der Bildung eines Esters mit Borsäure (->
Versuch).
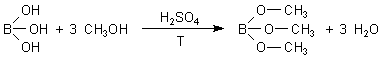
(Der Zusatz von Schwefelsäure ist nur nötig, wenn wir statt Borsäure ihre Salze, die Borate, einsetzen.)
Dieser Ester ist in der Hitze flüchtig und brennbar. Der Methylester verbrennt mit rein grüner Flamme, während wir beim Ethylester gelbe Flammen mit einem grünen Saum sehen. Das liegt daran, dass im Ethylester mehr Kohlenstoff enthalten ist, der beim Abbrennen die gelbe Flamme erzeugt.
Außerdem entsteht zusätzlich ein weißer Rauch. Der Grund: Der Borsäuremethylester verbrennt zu Kohlenstoffdioxid, Wasser und (was meistens vergessen wird) zu Boroxid B2O3! Letzteres ist das Anhydrid der Borsäure H3BO3. Es handelt sich hierbei um einen farblosen ("weißen") Feststoff, der als weißer Rauch aufsteigt.


Links: Methylester, rechts: Ethylester
(Fotos: Daggi)
Weitere Texte zum Thema „Alkohol“