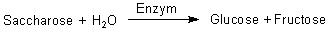
Die Geschichte der Michaelis-Menten-Gleichung
Lange Zeit galt die Beschäftigung mit Eiweißen und deshalb auch mit Enzymen nicht als Chemie und war unter den wahren Chemikern eher anrüchig. (Das klang später um 1960 bei der Gründung des Studiengangs Biochemie in Tübingen noch nach, wo die "richtigen" Chemiker über die Biochemiker die Nase rümpften - solange, bis sich die Nobelpreise für ausgesprochen biochemische Arbeiten häuften...). Das Ganze war den Leuten offenbar zu quallig.
1903 postulierte der französische Chemiker Victor Henri in seiner Arbeit "Lois générales de l´action des diastases", dass Enzymreaktionen durch eine Bindung zwischen dem Enzym und dem Substrat eingeleitet werden. Der Deutsch-Amerikaner Leonor Michaelis (1875-1947) und die Canadierin Miß Maud Leonora Menten (1879-1960) nahmen um 1910 Henris Arbeiten wieder auf und untersuchten die Kinetik eines Enzyms, der Saccharase. Es spaltet Saccharose in Glucose und Fructose:
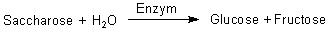
Die Kinetik dieses Enzyms kann man mit einfachen Mitteln verfolgen: Während der Reaktion ändert sich der Drehsinn des polarisierten Lichts, das mit der Reaktionsmischung wechselwirkt. Man braucht also nur Proben zu nehmen, deren Drehwinkel zu messen und das Ganze gegen die Zeit aufzutragen. Michaelis und Menten erhielten eine Abklingkurve, wie in der Kinetik üblich. (Weil der Drehsinn sich vom Positiven zum Negativen ändert, nennt man das Enzym auch Invertin oder Invertase.) Trugen sie die Anfangsgeschwindigkeiten dieser Reaktionen gegen die jeweilige Substratkonzentration auf, erhielten sie typische Sättigungskurven.
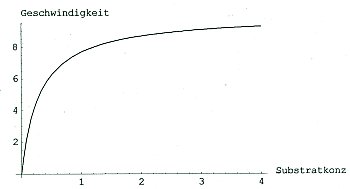
Bild 1: Michaelis-Menten-Diagramm
Michaelis und Menten konnten nicht nur Henris Hypothese bestätigen; sie konnten
seine Messungen verbessern und bis zur Veröffentlichung 1913 ihren Denkansatz
sogar mathematisch begründen [1].
Hier ist die berühmte Michaelis-Menten-Gleichung:
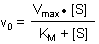
Was war überhaupt das Besondere im Vorgehen von
Michaelis und Menten?
Was war sozusagen der evolutionäre Schritt gegenüber den Arbeiten und
Erkenntnissen von Henri ? Dessen Messungen waren - wie die Erfahrungen zeigten -
nicht immer reproduzierbar. Lassen wir aber Michaelis und Menten selbst erzählen:
|
"... Wenn wir es unternommen haben, die ganze Arbeit wieder aufzunehmen, so liegt das daran, dass Henri zwei Momente noch nicht berücksichtigt hat, und die von ganz hervorragender Bedeutung geworden sind und deren Vernachlässigung in den Henrischen Arbeiten heute so schwer empfunden werden muss, dass eine Neuuntersuchung notwendig geworden ist. Das erste ist die Berücksichtigung der Wasserstoffionenkonzentration, das zweite die Berücksichtigung der Multirotation (modern: Mutarotation) des Zuckers..." [1] |
Abgesehen von der Notwendigkeit, vor der Polarisationsmessung das Mutarotations-Gleichgewicht
der entstehenden Zucker abzuwarten oder durch basische Katalysatoren (wie Natriumcarbonat) rasch
einzustellen, brachten Michaelis-Menten für kinetische Messungen an Enzymen eine völlig
neue Komponente ins Spiel: Das Konstanthalten des pH-Werts von
Enzymreaktionsmischungen durch Puffer. Sie nutzten dazu Natriumacetat/Essigsäure-Gemische.
Die Vorgeschichte dazu: Michaelis war Spezialist für Puffersysteme: Er begründete die
Berechnung von Puffern. Von ihm stammen die berühmten Michaelis-Gleichungen, die auch heute noch
die Grundlage der quantitativen Berechnung von schwachen Säure/Base-Systemen bilden.
Dazu Michaelis-Menten in ihrer Arbeit:
|
"Der Einfluss der Wasserstoffionenkonzentrationen ist durch die Arbeiten von Sörensen und von Michaelis und Davidsohn heute ganz klargestellt. Es wäre ein Zufall, wenn Henri in allen seinen Versuchen, bei denen er die Wasserstoffionenkonzentration nicht berücksichtigte, bei gleicher Wasserstoffionenkonzentration gearbeitet hätte. Das ist in den vorliegenden Untersuchungen überall berücksichtigt worden, einfach in der Weise, dass in allen Versuchen ein Acetatgemisch hinzugefügt wurde, das der Lösung die H·-Konzentration von 2 · 10-5 erteilte..." [1] |
Weiterhin erwies sich auch richtig, dass Michaelis und Menten als Erste die Anfangsgeschwindigkeit in den Mittelpunkt ihrer Überlegungen rückten. Hierzu schrieben sie:
|
"Henri hatte schon festgestellt, dass die Spaltungsprodukte der Inversion, die Glucose und Lävulose, einen hemmenden Einfluss auf die Invertinwirkung haben. Ganz prinzipiell werden wir nun hier auch so verfahren, dass wir den hemmenden Einfluss der Spaltprodukte - zunächst wenigstens - nicht rechnerisch berücksichtigen, sondern zunächst den Einfluss der Spaltprodukte experimentell ausschalten. Da dieser Einfluss nicht groß ist, ist die Durchführung dieses Prinzips leicht. Man braucht nämlich bei wechselnder Anfangskonzentration die Inversion der Saccharose immer nur so weit verfolgen, als sich der Einfluss der gebildeten Spaltprodukte noch nicht experimentell bemerkbar macht. Wir werden also zunächst in allen Versuchen immer nur die Anfangsgeschwindigkeit der Inversion bei wechselnder Anfangsmenge der Saccharose verfolgen..." |
Zum Schluss: Michaelis und Menten hatten einfach Glück
Sie haben für ihre Theorie zufällig mit der Invertase das richtige Enzym erwischt. Denn
dessen Enzym-Substratkomplex-Bildungsgleichgewicht stellt sich tatsächlich sehr
rasch ein, während die Folgereaktion unter Produktbildung vergleichsweise
vernachlässigbar langsam verläuft - entsprechend ihrer Hypothesen. Das ist nicht
selbstverständlich. Heute weiß man, dass bei den meisten Enzymen auch die
Zerfallsreaktion des Enzymsubstrat-Komplexes ES nach E + P nicht zu
vernachlässigen ist und sogar in der gleichen Größenordnung wie die
Bildungsreaktion von ES liegt. Darauf basieren erweiterte Gleichungen wie zum
Beispiel die der Steady-State-Kinetik von G. E. Briggs-Haldane
und J. B. S. Haldane (1925).
Diese werden aber weiterhin Michaelis-Menten-Gleichung genannt. Wir leiten sie in einer gesonderten
Webseite ab.
Trotzdem hätten nach heutigen Maßstäben Mr. Michaelis und Miss Menten einen Nobelpreis bekommen müssen. Denn ihr Verdienst ist es, dass die Enzymologie endlich aus ihrer viel belächelten Nischenstellung herauskam und auf eine wissenschaftliche Basis gestellt wurde. Damit wurden die Enzymreaktionen endlich quantifizierbar, und die Messungen konnten reproduzierbar gestaltet werden. Der Siegeszug der Enzyme und damit der der Biochemie begann.
Literatur:
[1] L. Michaelis und M. L. Menten: Die Kinetik der Invertinwirkung, Biochem. Z.
(Biochemische Zeitschrift) 49, 333-369 (1913)
Weitere Texte zum Thema „Reaktionskinetik“