Die exemplarische Reaktionskinetik: Entfärbung von Indikatoren (Kristallviolett)
Experimente:
Versuch: Lambert-Beersches-Gesetz
Versuch: Qualitative Demonstration der Entfärbung von Kristallviolett durch
Natronlauge
Versuch: Reaktionskinetik der Entfärbung von Kristallviolett
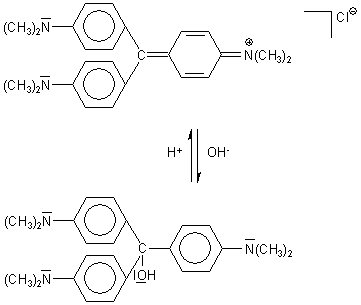
Mit dem Triphenylmethanfarbstoff Kristallviolett (KV) kann man in ausgezeichneter Art
und Weise das Lambert-Beersche Gesetz bestätigen (-> Versuch).
Aber auch zur Demonstration der Prinzipien der chemischen Reaktionskinetik ist Kristallviolett geeignet. Als ungesättigte Verbindung addiert Kristallviolett nämlich OH--Ionen; dabei wird die Lösung entfärbt (-> Versuch).
Hinweis für Schulen
Mittlerweile darf Kristallviolett nicht mehr in der Schule verwendet werden, da es cancerogene Verbindungen
wie Diphenylamin-Derivate freisetzen kann. Unsere Empfehlung: Nehmen Sie bei dem Versuch stattdessen Phenolphthalein,
das in alkalischem Milieu rot gefärbt ist. Das Absorptionsmaximum liegt bei 553 nm. Den folgenden Text müssen Sie
sich entsprechend geändert vorstellen…

Bei der Reaktion bildet sich eine Carbinolbase, wobei der für die Farbigkeit von KV verantwortliche großflächige Mesomerie des Moleküls unterbrochen wird. Die Entfärbungsreaktion ist übrigens reversibel: Durch Ansäuern der Carbinollösung bildet sich der Farbstoff zurück. (Diese Reaktion beobachtet man auch beim Phenolphthalein; -> Versuch.)
Die Geschwindigkeit dieser Entfärbungsreaktion kann durch die Konzentration der OH--Ionen gesteuert werden. Sie ist deshalb ein Beispiel für eine Reaktion pseudo-1. Ordnung (-> Versuch). Dabei setzt sich ein Stoff in einer bimolekularen Reaktion mit einem Reaktionspartner um, dessen Konzentration konstant bleibt.
Zur reaktionskinetischen Betrachtung schreiben wir die Reaktion kürzer:
KV+ + OH- ———> KV-OH
Die Gleichung für die Reaktionsgeschwindigkeit der Reaktion 2. Ordnung lautet
d[KV] / dt = - k · [KV] · [OH-]
und unter den Bedingungen pseudo-1. Ordnung
d[KV] / dt = - k' · [KV]
Dabei ist k' die Geschwindigkeitskonstante einer Reaktion pseudo-1. Ordnung.
k' = k · [OH-]
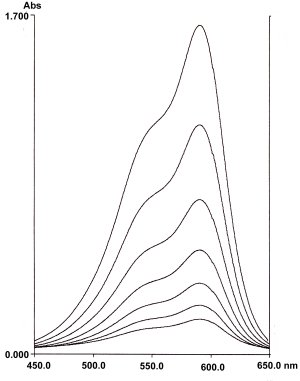
Zeitliche Veränderung der Absorptionsspektren von Kristallviolett in verdünnter Natronlauge.
Zwischen den Spektren liegen jeweils gleiche Zeitabstände
Der Ablauf der Reaktion wird photometrisch verfolgt. Da der Farbstoff vollständig zerstört wird, kann man zur Auswertung der Messungen die Konzentrationen direkt durch die Extinktionswerte ersetzen. Das Konzentrations-Zeit-Gesetz lautet dann in der Extinktions-Form:
E(t) = E0 · exp (- k' · t)
Aus dieser Darstellung kann man bei E0/2 die Halbwertszeit ablesen. Die kinetische Zeit liest man bei E0/e ab.
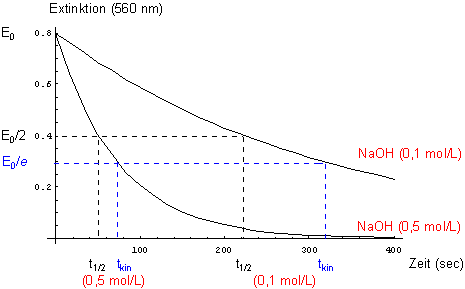
E = f (t) für die Entfärbungsreaktion von Kristallviolett
Zur Überprüfung der Reaktionsordnung wird dieses Gesetz logarithmiert.
ln E(t) = ln E0 - k' · t
In dem Diagramm ln E = f (t) müssen die Messwerte alle auf einer Gerade liegen. Das tun sie zumindest für die erste Hälfte der Reaktionsdauer. Man kann daraus durch Extrapolation auch den Anfangswert E0 ermitteln.
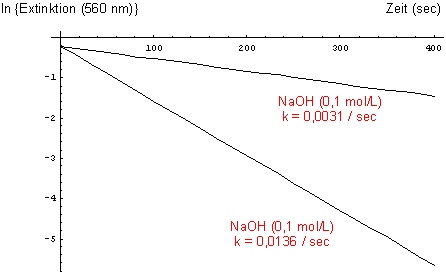
ln E = f (t) für die Entfärbungsreaktion von Kristallviolett
Aus der Steigung der Gerade berechnet man die Geschwindigkeitskonstante 1.
Ordnung k'. Diese ist auch aus der Halbwertszeit zugänglich:
t1/2 · k' = ln 2
oder aus der kinetischen Zeit:
t1/e · k' = 1
Zur Berechnung der Geschwindigkeitskonstanten 2. Ordnung k zeichnet man gemäß der Definition
k' = k · [OH-]
ein Diagramm k' gegen [OH-]. Bei [OH-] = 1 mol/l ist k' = k.
Man kann die Beziehung auch logarithmieren. Mit pOH + pH = 14 folgt dann
log k' = log k - 14 + pH
Man trägt log k' gegen den pH-Wert auf; bei pH = 14 ist log k' = log k.
Weitere Texte zum Thema „Reaktionskinetik“