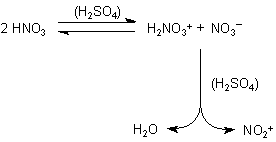
Nitriersäure und Nitrierung von Aromaten und Alkoholen
Experimente:
Versuch: Herstellung von Cellulosetrinitrat
Schwefelsäure ist bei vielen organischen Synthesen unverzichtbar. Denn Schwefelsäure
ist ein Stoff mit hoher H+-Konzentration und zugleich mit stark wasserentziehender
Wirkung. Ihre Protonen wirken als Katalysator und dienen als solche zur Polarisierung von
Bindungen, während sich die wasseranziehende Wirkung besonders bei Kondensationen wie etwa
der Veresterung reaktionsfördernd bemerkbar macht.
Ähnlich wirkt konzentrierte Schwefelsäure auf Salpetersäure HNO3. Diese Mischung aus konzentrierten Säuren heißt Nitriersäure. In ihr laufen folgende Reaktionen ab:
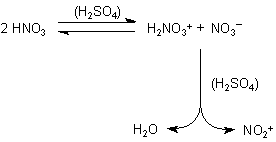
Zunächst einmal findet formal ein Protonenaustausch zwischen zwei HNO3-Molekülen statt. An der Protonierung ist sicherlich auch die Schwefelsäure beteiligt. Durch die Wasserabspaltung entsteht aus dem protonierten Molekül ein Nitryl-Kation NO2+. Dieses Kation (auch Nitronium-Ion genannt) ist übrigens isoelektronisch und isoster zum CO2-Molekül.

Das Nitryl-Kation ist ein wichtiges Elektrophil. Es dient zur Substitution unter Einführung von Nitro-Gruppen (R-NO2).
R-H + NO2+ ———> R-NO2 + H+
Nitrierungen sind besonders wichtig in der Chemie der aromatischen Verbindungen. Mit Benzol bildet sich das nach Bittermandelöl duftende, allerdings giftige Nitrobenzol.
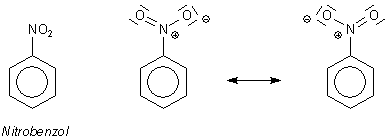
Nitrobenzol und mesomere Grenzstrukturen der Nitrogruppe
Die Nitrierung kann noch weitergehen. Als starker (-I, -M)-Substituent drückt die erste
Nitrogruppe die weiteren Substituenten in meta-Stellung, erschwert aber insgesamt den
Angriff eines weiteren Elektrophils.
Mit Toluol bildet sich Trinitrotoluol (TNT). Hier wirkt die Methylgruppe mit ihrem (+I)-Effekt
aktivierend.
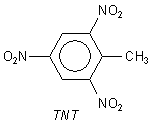
Nitroaromaten sind nicht nur Sprengstoffe, sondern vor allem auch Ausgangsstoffe zur Synthese von Farbstoffen oder Arzneimitteln. Sie lassen sich leicht zu Aminogruppen reduzieren. So entsteht aus Nitrobenzol einer der wichtigsten Grundstoffe dieser Industrie, das Anilin. Geschichtlich haben Farbstoffchemie und Medikamentenchemie gleiche Wurzeln. Der Grund: Die Feststellung von Robert Koch, dass man selektiv Bakterien und Zellen anfärben kann, führte zur Erkenntnis, dass man auch mit anderen Stoffen selektiv Bakterien angreifen können müsste.
Mit Glycerin bildet sich unter Einwirkung von Nitriersäure Nitroglycerin. Die Vorsilbe Nitro ist eigentlich nicht richtig, denn es handelt sich um einen Salpetersäureester. Er müsste also eher Glycerintrinitrat heißen. Das erkennt man schon daran, dass anders als bei den aromatischen Nitroverbindungen die Nitrogruppe nicht an einem C-Atom fixiert ist, sondern an einem Sauerstoffatom.
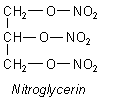
Aus Nitroglycerin stellt man übrigens nicht nur Dynamit her, sondern auch wichtige herzaktivierende Medikamente.
Ein Salpetersäureester liegt auch beim Cellulosetrinitrat vor, der Schießbaumwolle (-> Versuch). Dieser Ester ist auch als gut brennbarer Kunststoff Celluloid bekannt.
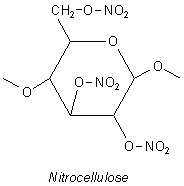
Wie alle Ester kann man diese Art von Nitroverbindungen alkalisch spalten.
Weitere Texte zum Thema „Schwefel“