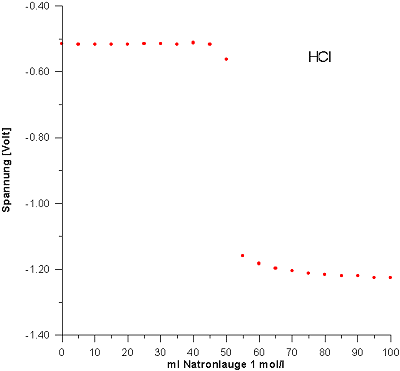
Vorlage: 50 ml HCl (c = 1 mol/l)
Säure/Base-Titrationskurven mit der Antimonelektrode
Elektroden: Antimon gegen Hg/HgSO4 (ges. K2SO4)
(Zu dieser Webseite vergleiche die Basiswebseite.)

Vorlage: 50 ml HCl (c = 1 mol/l)
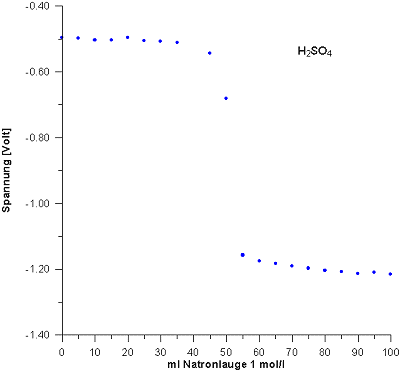
Vorlage: 50 ml H2SO4 (c = 0,5 mol/l)
Obwohl die zweite Stufe der Schwefelsäure, also das Hydrogensulfat-Anion, eine schwache Säure ist (pK-Wert = 1,92), zeigt die Kurve bei 37,5 ml Zugabe, anders als erwartet, keinen zusätzlichen Wendepunkt. Grund ist, dass er durch das Wassergleichgewicht H3O+/H2O überlagert ist.
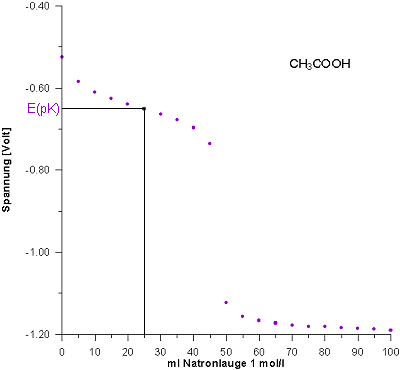
Vorlage: 50 ml CH3COOH (c = 1 mol/l)
Der pK-Wert der Essigsäure liegt bei pH = 4,76.
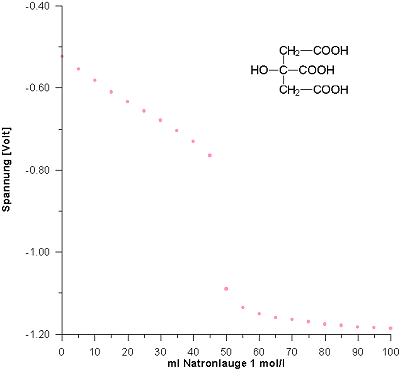
Vorlage: 50 ml Citronensäure (c = 0,33 mol/l)
Obwohl bei der Citronensäure drei Säure/Base-Gleichgewichte eine Rolle spielen, zeigt die Kurve keine ausgeprägten Wendepunkte, die wir bei 50/6, 3 · 50/6 und 5 · 50/6 ml Zugabe erwarten. Grund ist, dass die drei Gleichgewichte sich stark überlagern und die pK-Werte deshalb zu eng aufeinander liegen (pK1 = 3,14; pK2 = 5,95; pK3 = 6,39).
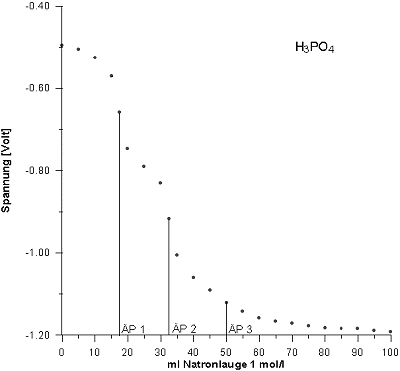
Vorlage: 50 ml H3PO4 (c = 0,33 mol/l)
Zur Kurve der Phosphorsäure: Den wegen zu stark saurem Startbereich wegen der Überlagerung des Wassergleichgewichts H3O+/H2O nicht als Wendepunkt ausgeprägten pK1 (entsprechend dem pH-Wert 2,16) findet man, indem man die ml-Zahl bis zu ÄP1 halbiert.
Die Kurve zeigt auch keinen Wendepunkt bei pK3 (entsprechend dem pH-Wert 12,67), da dieser durch das
Wassergleichgewicht H2O/OH- überlagert wird. Du erhältst den Wert aber aufgrund der Tatsache,
dass die Abszissenabstände von pK1 zu pK2 und auch zu pK3 identisch sein müssen.
Auf die gleiche Weise findest du ausgehend von den anderen beiden Äquivalenzpunkten auch den dritten Äquivalenzpunkt (ÄP3).
Hier sind die genauen Ergebnisse:
| pK1 | ÄP1 | pK2 | ÄP2 | pK3 | ÄP3 |
| 50/6 = 8,33 ml NaOH | 50/3 = 16,67 | 3 • 50/6 = 25 | 2 • 50/3 = 33,33 | 5 • 50/6 = 41,67 | 50 |