Prof. Blumes Tipp des Monats Februar 1999 (Tipp-Nr. 20)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Potentiometrische Säure/Base-Titrationen ohne pH-Meter
Es gibt viele Möglichkeiten für Säure/Base-Titrationen ohne pH-Meter. Bei jeder Methode kannst du eine Menge über Chemie lernen. Du benötigst nur irgendein Signal, das das Erreichen des Äquivalenzpunkts anzeigt. Das einfachste Beispiel ist die Titration mit Indikatoren. Weiter ist die thermometrische oder kalorische Titration zu nennen. Du kannst dich auch elektrochemischer Methoden bedienen. Bekannt ist dir sicherlich schon die Leitfähigkeitstitration. Es geht aber auch potentiometrisch.
Anstelle der unhandlichen Standard-Wasserstoffelektrode oder der für Schülerhände oftmals viel zu empfindlichen und zuvor zu eichenden Glaselektrode verwenden wir eine Metallelektrode. Mit der kannst du auch ohne teures pH-Meter typische Titrationskurven aufnehmen (-> Graphiken). Bei schwachen Säuren erhältst du sogar die Wendepunktskurven mit den "pK-Werten".
Grundlage des Verfahrens ist die Tatsache, dass die Lage der Redoxgleichgewichte einiger Metalle pH-abhängig ist. Ein Beispiel ist das Antimon. Es zeigt je nach pH-Bereich zwei Gleichgewichte, deren Potentiale sich stark unterscheiden. Grundsätzlich liegt wie bei jedem Metall, das in Wasser taucht, erst einmal folgendes Grundgleichgewicht vor:
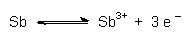
Unterschiedlich sind je nach pH-Wert die Folgereaktionen. Im Sauren bilden sich
Kationen, im Alkalischen Anionen. Du kennst dieses Verhalten sicherlich vom
Aluminium. Das Stichwort heißt Ampholyt oder amphoterer
Stoff.
Wir müssen die Redoxgleichgewichte folglich von vornherein anders formulieren:
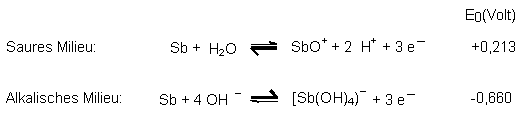
Aus der Lage der Gleichgewichte bzw. aus den E0-Werten erkennen wir, dass das
Metall im sauren Milieu edler ist als im alkalischen.
Die unterschiedliche Stabilität hat ihren Grund darin, dass sich
unterhalb von pH 7 sehr viele Kationen bilden, die das Metall umhüllen
und damit die Abgabe von weiteren Kationen erschweren. Das Redox-Gleichgewicht liegt eher auf
der linken Seite, das Metall erscheint edel.
Anders oberhalb von pH 7: Hier wird der (sich zunächst bildende)
Niederschlag von Antimonhydroxid Sb(OH)3 unter Komplexbildung aufgelöst. Es
können somit leicht weitere Antimon-Ionen abgegeben werden. Das Redox-Gleichgewicht liegt
auf der rechten Seite; das Metall erscheint unedler.
Das amphotere Verhalten des Antimons hat aber auch Auswirkungen auf seine elektrischen Eigenschaften. Unterhalb von pH 7 ist die Tendenz zur Elektronenabgabe gering. Damit wirkt Antimon gegenüber einer Wasserstoffelektrode positiv. Oberhalb von pH 7 ist die Abgabe von Elektronen erleichtert; die Elektrode wirkt stärker negativ. (Dies besagt auch der Vergleich der E0-Werte in der obigen Tabelle.) Es ist also zu erwarten, dass beim Wechsel vom sauren zum alkalischen Milieu ein erheblicher Potentialsprung ins Negative stattfindet.
Um genauer zu untersuchen, wie das Redoxpotential des Antimons vom Säure/Base-Milieu der Lösung abhängt, titrieren wir eine bekannte Säurelösung mit Natronlauge. Anstelle des pH-Wertes notieren wir für jede Zugabe von Natronlauge den Spannungswert, den wir zwischen einer Antimon-Elektrode und einer pH-unabhängigen Bezugselektrode messen. Als letztere nehmen wir eine der bekannten Elektroden II. Art auf der Basis von Kalomel, Silberchlorid oder Mercurisulfat.
|
Versuch: Aufnahme von Titrationskurven zur Ermittlung der
pH-Abhängigkeit des Potentials von Antimon
1 Herstellung der Metall-Elektrode
(Abzug!)
2 Herstellung einer Bezugselektrode
3 Aufnahme einer Titrationskurve
Prüfe auch andere Säuren (z. B. Schwefel-, Essig-, Zitronen- und Phosphorsäure). Dreibasige Säuren titrierst du in Zugabeschritten von 2,5 ml. Zur Herstellung der Säurelösungen siehe Tipp des Monats September 1998. Hinweis: Falls du kein Messsignal erhältst: Prüfe die Bezugselektrode. Meistens fehlt im Innenraum der Elektrolyt (Kaliumchlorid- bzw. Kaliumsulfat-Lösung). |
| Klick mich an! |
 |
| Versuchsaufbau mit selbst gebauter Bezugselektrode |
Betrachtest du die Titrationskurven, so erkennst du, dass die Redoxpotentiale
tatsächlich eine starke Abhängigkeit vom pH-Wert zeigen. (Um die
gemessenen Spannungswerte besser verstehen zu können, schaue dir die
Webseite zur Potentialberechnung an.)
Du findest Wendepunkte, aus denen sich der Äquivalenzpunkt (hier bei 50
ml Zugabe an Natronlauge) ziemlich exakt ermitteln lässt. Mit Hilfe bekannter
pH- und pK-Werte kannst du eine Kennlinie E = f(pH) für die
Antimon-Elektrode erstellen. Beispiele sind der Neutralisationspunkt starker Säuren (pH 7)
sowie pK-Werte der schwachen Säuren. Du kannst aber auch
während einer Titration simultan Spannung und pH-Wert ermitteln, indem du einmal
zusätzlich ein pH-Meter benutzt. Mit der Kennlinie kannst du dann unter Verwendung der
Antimon-Elektrode sogar einzelne pH-Werte bestimmen.
Bleibt noch die Frage, ob du nicht auch eine Elektrode aus dem Aluminium verwenden könntest. Du wirst rasch feststellen, dass dieses Metall so amphoter ist, dass es sich in der Säure wie in der Lauge deutlich auflöst und damit für die Messung wertlos ist. Antimon ist wegen seines edleren Charakters für unsere Zwecke besser geeignet. Versuche es aber einmal mit Bismut. Bei letzterem überrascht der Erfolg, da dieses Metall kaum als amphoter gilt. Dennoch löst sich offenbar noch soviel Hydroxid in alkalischen Lösungen, dass der Potentialsprung bei pH 7 deutlich zu erkennen ist.
Rüdiger Blume
Literatur zu den Oxiden bzw. Hydroxiden von Antimon und Bismut:
Holleman-Wiberg, Lehrbuch der Anorganischen Chemie, Walter de
Gruyter, Berlin - New York 1995; 101. verbesserte und stark erweiterte Auflage.
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 12. August 2008, Dagmar Wiechoczek