Prof. Blumes Tipp des Monats September 1998 (Tipp-Nr. 15)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.

Olga beim Titrieren (Foto: Daggi)
Schnell und einfach gemacht:
Exakt eingestellte Schwefelsäure- oder Phosphorsäurelösungen
Titrationen sind im Schulalltag beliebt. Mit ihnen kann man Schüler nicht nur sinnvoll
beschäftigen, sondern sie lernen dabei viel über Säure-Base-Reaktionen und über
Stöchiometrie. Auch der Umgang mit Laborgeräten muss schließlich erlernt werden.
Erfahrungsgemäß titrieren Schüler sehr gern.
Aber es soll ja nicht immer bei der Salzsäure bleiben. Zur Abwechslung nimmt man gern
einmal die zweiprotonige Schwefelsäure oder gar die dreiprotonige Phosphorsäure. Für
Anfänger, die diese Säuren noch nicht kennen, bietet sich hier Diskussionsstoff, warum
Lösungen von Salz-, Schwefel- und Phosphorsäure trotz gleicher Molaritäten unterschiedliche
Mengen an Natronlauge zur Titration benötigen.
Oft möchte man auch Titrationskurven
aufnehmen. Anhand des Vergleichs der Kurven von
Salzsäure und Essigsäure kann man besonders gut die Theorie der pKs-Werte und der
Pufferung einführen. Die Phosphorsäure erlaubt die Diskussion des Einflusses der OH¯-Ionen
auf die Lage des pK3-Werts. Man kann weiter die Titrationskurven
der beiden dreiprotonigen Säuren Phosphor- und Citronensäure vergleichen. Hierbei
spielen die unterschiedlichen Differenzen der drei pKs-Werte
eine wichtige Rolle. Außerdem kann man wie bei der Essigsäure die Äquivalenzpunkte
mit den Umschlagsbereichen der jeweiligen Indikatoren korrelieren.
Zu all dem benötigt man exakt eingestellte Säuren und Laugen. Gerade in Schullabors
ist es schwierig, eine Schwefelsäure oder gar eine Phosphorsäure mit exakter
Konzentration herzustellen:
Bei der Schwefelsäure geht man von konzentrierter
Säure aus, die man verdünnen muss. Wie sauber allerdings die Ausgangssäure
war, ob sie nicht schon durch langes Stehen aufgrund ihrer Hygroskopie Wasser gezogen hat -
alles Unbekannte, die zur Verfälschung führen. Und wer gibt sich schon die Mühe
zur Dichtemessung?
Und dann gar die Phosphorsäure! Hier geht man meistens von
Phosphorpentoxid aus. Das muss allerdings frisch und trocken sein, ein seltener Zustand im
Schullabor.
Eine weitere, im Labor mit exakter Stoffmengenkonzentration schwer herzustellende Säure ist die Essigsäure. Das liegt an der niedrigen Siedetemperatur der reinen Essigsäure.
Zum Kaufen von allzu vielen Maßlösungen ist meist nicht genügend Geld da. Außerdem werden die meisten, aus Ampullen zubereiteten Maßlösungen (anders als die der Salzsäure) häufig nicht allzu oft gebraucht, stehen herum und blockieren teure Gefäße. Weiter verderben verdünnte Schwefel- und Phosphorsäuren relativ rasch, da sie anders als Salzsäure ein hervorragendes Wachstumsmedium für Pilze und Bakterien sind.
Besser ist es also, wenn man sich die Lösungen in kleinen, für den jeweiligen Zweck ausreichenden Mengen rasch selber herstellt:
| - | Laugen lassen sich durch Abwiegen von trockenem Natriumhydroxid zubereiten. Erfahrungsgemäß ist immer relativ frische Substanz vorhanden. |
| - | Die Herstellung von Säuren
ist ebenfalls ganz einfach: Man löst ein gut definiertes Natrium- oder Kaliumsalz der
herzustellenden Säure in einer entsprechend konzentrierten Salzsäure.
Deren Protonen reagieren dann im chemischen Gleichgewicht mit den Säure-Anionen.
Sulfat-Ionen bilden mit einem Teil der Protonen der Salzsäure die schwache Brönsted-Säure Hydrogensulfat: 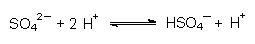 Die Lösung verhält sich insgesamt wie verdünnte Schwefelsäure. Phosphat-Ionen bilden die schwache Phosphorsäure: 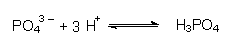 Die Lösung verhält sich insgesamt wie verdünnte Phosphorsäure. Acetat-Ionen bilden die schwache Essigsäure: 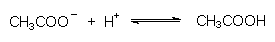 Die Lösung verhält sich insgesamt wie verdünnte Essigsäure. |
Die nach den folgenden Rezepten hergestellten Lösungen sind verdünnte, kochsalzhaltige Säuren. Die Natrium-Ionen stören nicht bei der Titration. Denn Natrium- und Chlorid-Ionen verhalten sich (außer in extremen pH-Bereichen und bei zu hohen Konzentrationen) völlig inert gegenüber dem Säure-Base-Verhalten des Milieus, in dem sie gelöst vorliegen. Mit diesen Lösungen kann man deshalb mit Hilfe einer Glaselektrode bzw. Antimonelektrode sogar die üblichen Titrationskurven aufnehmen.
|
Beispiele
Beim Berechnen der abzuwiegenden Salzmengen etwaiges Kristallwasser berücksichtigen! Spartipp: Nehmen Sie möglichst verdünnnte Lösungen. Die Konzentration c = 0,05 mol/L reicht bei Schwefelsäure völlig aus. Für die Phosphorsäure genügt eine Konzentration c = 0,03 mol/L. Rechnen Sie vorher die benötigten Mengen aus. Dabei daran denken, dass in den Lösungen Pilze und Bakterien wachsen können. Lösungen deshalb nicht zu lange aufbewahren! Kontaminierte Gefäße gut reinigen. Schwefelsäure Aufgabe: 1000 ml einer Schwefelsäure mit c = 0,1 mol/L sollen hergestellt werden. Diese ist 0,2molar an Protonen. Durchführung: Man löst 0,1 mol Natriumsulfat in Salzsäure (c = 0,2 mol/L) (Xi) und füllt mit der Salzsäure auf 1 L auf. Man kann auch 0,1 mol Natriumhydrogensulfat (Xi) in Salzsäure (c = 0,1 mol/L) lösen. Phosphorsäure Aufgabe: 1000 ml einer Phosphorsäure mit c = 1 mol/L sollen hergestellt werden. Diese ist 3molar an Protonen. Durchführung: Man löst 1 mol Natriumphosphat in Salzsäure (c = 3 mol/L) (C) und füllt mit der Salzsäure auf 1 L auf. Alternativ löst man 1 mol Dinatriumhydrogenphosphat in Salzsäure (c = 2 mol/L) (Xi). Man kann auch 1 mol Natriumdihydrogensphosphat in Salzsäure (c = 1 mol/L) (Xi) lösen. Essigsäure Aufgabe: 1000 ml einer Essigsäure mit c = 0,05 mol/L sollen hergestellt werden. Diese ist 0,05molar an Protonen. Durchführung: Man löst 0,05 mol Natriumacetat in Salzsäure (c = 0,05 mol/L) (Xi) und füllt mit der Salzsäure auf 1 L auf. |
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 15. Juni 2015, Dagmar Wiechoczek