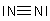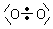Experimente:
Versuch: Aussalzen von Gas aus seiner wässrigen Lösung
Sauerstoff und Stickstoff liegen in der Luft im Verhältnis von O : N = 1 : 4 vor. In
Wasser dagegen ist Sauerstoff stark angereichert. Hier liegt das Verhältnis von O : N
bei 1 : 1,8. Genau: Bei 0 °C lösen sich in 1 Liter Wasser 10,3 ml O2 und
18,1 ml N2. Das ist für das Leben im Wasser wichtig. Wie man zu diesen Zahlen kommt,
erklären wir hier.
Auf diese Frage, warum das so ist, eine allgemein gültige Antwort zu finden, ist
schwierig. Betrachten wir deshalb zunächst einmal die Unterschiede zwischen den
beiden Gasen und versuchen wir, diese Unterschiede mit ihrer Löslichkeit in
Verbindung zu bringen.
Vorneweg ein Hinweis: Wassermoleküle bilden um das zu lösende Gasmolekül nicht
nur Hydratkäfige, sondern können auch Wasserstoffbrücken
bilden.
Zurück zu den Gasen: Beide bestehen aus binären Molekülen: O2 und N2.
| 1. |
Beim Stickstoff sind die Elektronen auf Grund der Dreifachbindung
hauptsächlich zwischen den beiden N-Atomen lokalisiert, wo sie ziemlich stabil angeordnet sind.
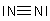
Anders beim Sauerstoff: Die Sauerstoffatome zeigen ein völlig anderes
Elektronenmuster als der Stickstoff. Bekanntlich ist Sauerstoff paramagnetisch, weil
es ein Biradikal ist.
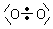
Ungleiche und weniger stationäre Ladungsverteilung ist ein Angriffspunkt für polare
Lösungsmittel wie Wasser. Hier ist der Sauerstoff im Vorteil: Er hat mehr
nichtbindende Elektronen-Paare als Stickstoff; dazu kommen noch die
ungepaarten, radikalischen Elektronen. |
| 2. |
Vielleicht spielt auch die unterschiedliche EN (Sauerstoff:
3,5 und Stickstoff: 3) eine Rolle. |
| 3. |
Auffällig sind auch die unterschiedlichen Bindungslängen:
Sauerstoff 1,2074 und Stickstoff 1,0976 Ångström. Das mag für die Bildung der Wasserkäfige
wichtig sein. |
Für unsere Überlegungen der Wechselwirkung zwischen Gasen und Lösemittel spricht
vor allem Folgendes: Verändert man die Eigenschaften des Lösungsmittels durch
Zusatz von Elektrolyten, sollte sich auch die Löslichkeit von solchen Gasen anders
darstellen. So kann man tatsächlich die Löslichkeit durch Lösungskonkurrenz ändern.
Bekannt ist der Aussalzeffekt auf gelöste Gase: Gibt man zu einer gesättigten
Gaslösung die konzentrierte Lösung eines Inertsalzes wie Natriumchlorid, so entweicht
das Gas (-> Versuch). (Für Spezialisten: Ionische Salzlösungen
beeinflussen sehr stark die Aktivitätskoeffizienten.)
Deshalb ist die Löslichkeit von Sauerstoff und Stickstoff im Meerwasser auch geringer
als in Süßwasser oder gar in destilliertem Wasser.
Die positive Wirkung von ungelösten Salz- (oder Zucker-)Kristallen auf das Austreiben
in Wasser gelöster Gase beruht dagegen auf einem anderen Effekt.
(Dank für Diskussion an Dr. E. Diemann)
Weitere Texte zum Thema „Wasser“