
Schweres Wasser
In vielen chemischen Forschungslaboren stehen Flaschen mit der Aufschrift Deuteriumoxid. Das benötigt man als Lösemittel für die Kernresonanzspektroskopie (NMR-Spektroskopie).

Deuteriumoxid ist nichts anderes als schweres Wasser.
Was ist das genau? Um das zu klären, müssen wir die Atome des Wasserstoffs genauer betrachten.
Vom Wasserstoff gibt es drei Atomarten
Untersucht man die Atome von Wasserstoff, so stellt man fest, dass sie nicht alle die gleichen
Atommassen aufweisen. Einige sind schwerer als die durchschnittlichen Atome. Woher kommen die
Massenunterschiede?
Zwar haben alle Atome eines Elements immer die gleiche Anzahl von Protonen (und damit auch die gleiche Anzahl von Elektronen); aber ihre Neutronenzahlen können variieren. Das beeinflusst natürlich in erster Linie die Massezahl dieser Teilchen. Atome eines Elements mit unterschiedlichen Massezahlen nennt man Isotope (vom griechischen isos, gleich und topos, Ort; das heißt am gleichen Ort (im PSE) stehend). Vom Wasserstoff gibt es deren drei.
Zur Kennzeichnung der Isotope hat man eine besondere Schreibweise entwickelt. Die Massezahlen schreibt man als Hoch-Index vor das chemische Elementsymbol. Der Tief-Index vor dem Symbol ist die Elementnummer im PSE. Er ist gleich der Zahl der Protonen im Atomkern.

Der Atomkern der leichtesten Wasserstoffart besteht nur aus einem Proton. Beim schwereren Wasserstoff kommt ein Neutron hinzu. Der überschwere Wasserstoff hat sogar noch ein Neutron mehr.
Je leichter ein Element ist, desto stärker macht sich diese Massendifferenz bemerkbar. Am auffälligsten ist dieser Effekt deshalb bei Wasserstoff als dem leichtesten Element überhaupt. Die Massen seiner drei Isotope verhalten sich wie 1:2:3. Aus diesem Grund unterscheiden sich die drei Isotope des Wasserstoffs so stark in ihren stofflichen Eigenschaften, dass man sogar eigene Namen und eigene chemische Symbole für sie benutzt.
| Isotope des Wasserstoffs | |||
| Bezeichnung | Name | Chemisches Symbol | Natürliches Vorkommen |
| Leichter Wasserstoff | Protium | H | 99,99 % des Wasserstoffs |
| Schwerer Wasserstoff | Deuterium | D | 1 D-Atom / 6500 H-Atome |
| Superschwerer Wasserstoff | Tritium | T | Nur Spuren |
Nun verstehen wir auch, dass der Begriff Deuteriumoxid für eine schwerere Form des Wassers stehen muss, eben für „Schweres Wasser“. Seine chemische Formel ist D2O.
Woher kommen überhaupt die verschiedenen Wasserstoff-Isotope?
Die Bildungsprozesse sind physikalische Vorgänge.
Protium 1H ist die weitaus häufigste Atomart des Weltalls. Es hat sich gleich zu Beginn der Entstehung des Weltalls aus anderen Elementarteilchen wie den Quarks gebildet. Aber auch jetzt noch laufen überall im Weltall entsprechende Prozesse ab. (Siehe z. B. auch Gleichung (3) weiter unten.)
Deuterium 2H entsteht aus leichtem Wasserstoff, indem dessen Atomkerne ein langsames Neutron (Symbol n) einfangen.
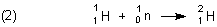
Dieser Prozess spielt auch eine Rolle in Leichtwasserreaktoren, die mit „normalem“ Wasser H2O gekühlt werden.
Tritium 3H bildet sich in der Natur durch „Beschuss“ von Stickstoffatomen mit schnellen Neutronen, die aus kosmischen Kernprozessen stammen. Dies ist aber eher eine Nebenreaktion; denn in erster Linie bildet sich dabei das schwere Kohlenstoff-Isotop C-14, das bei der geologischen und archäologischen Altersbestimmung eine wichtige Rolle spielt.
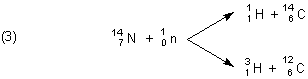
Aus diesem Grund ist die natürliche Konzentration des Tritiums sehr gering. Hinzu kommt, dass es stark radioaktiv ist. Seine Halbwertszeit beträgt nur 12,35 Jahre.
Daneben gibt es noch eine Reihe kerntechnischer Verfahren, um Tritium in größeren Mengen herzustellen. Das benötigt man z. B. zum Betrieb von Fusionsreaktoren.
Schweres Wasser
Deuterium D und Tritium T reagieren chemisch gesehen allesamt wie leichter Wasserstoff H. So gibt es mit D2
oder T2 in Gegenwart von Sauerstoff sicherlich genauso eine Knallgasexplosion wie mit H2, die
zur entsprechenden Wasserart (D2O und T2O) führt.
Alle drei Wasserarten sehen gleich aus: Sie sind bei Zimmertemperatur farblose und leicht bewegliche Flüssigkeiten.
Auch wenn in einem Wassermolekül die beiden Wasserstoffatome verglichen mit dem Sauerstoffatom relativ leicht sind: Die Massenunterschiede zwischen den drei Wasserarten H2O, D2O und T2O sind so groß, dass sich viele physikalische und chemische Eigenschaften der verschiedenen Wasserarten deutlich unterscheiden. Man spricht von einem Isotopeneffekt. Die folgende Tabelle zeigt Beispiele für H2O und D2O. (Daneben gibt es noch die Mischform DHO, auf die wir hier aber nicht weiter eingehen. Deren Eigenschaften liegen zwischen den Reinformen.)
| Vergleich von leichtem Wasser und schwerem Wasser | ||
| Eigenschaften | H2O | D2O |
| Relative Molekülmasse (g/mol)
Maximale Dichte (g/cm3) Temperatur des Dichtemaximums (°C) Schmelzpunkt (°C) Siedepunkt (°C) Ionenprodukt des Wassers (25 °C) pKw-Wert (25 °C) Bildungsenergie (kJ/mol) Löslichkeit von NaCl (25 °C) (g/100 mL Wasser) |
18,0151
1,0000 3,98 0,00 100,00 1,0 · 10-14 14,00 286,0 35,9 |
20,0276
1,1059 11,23 3,81 101,42 1,35 · 10-15 14,87 294,8 33,7 |
Chemische Unterschiede
Weil H-Atome deutlich leichter sind als D-Atome, sind Verbindungen, die erstere enthalten, reaktiver.
So dissoziiert D2O weniger als H2O. Deshalb ist das Ionenprodukt
von D2O kleiner als das von H2O.
Wegen der unterschiedlichen Reaktivität sind „deuterierte“ Verbindungen für Lebewesen sogar giftig.
Mischungen von Ionen bildende Verbindungen mit unterschiedlichen Wasserstoff-Isotopen zeigen außerdem einen Effekt, der zum Verständnis des Ablaufs vieler chemischer Reaktionen beigetragen hat. Es handelt sich um die Protonen-Austauschreaktionen.
Leitet man z. B. „leichtes“ Ammoniak NH3 in „schweres“ Wasser D2O ein, so stellt man bald fest, dass sich deuteriertes Ammoniak gebildet hat. Daraus schloss man, dass Ammoniak mit Wasser reagiert und intermediär eine Verbindung bildet, in der alle Wasserstoffatome „gleichberechtigt“ sind. Diese Verbindung ist (wie wir heutzutage alle wissen…) das Ammonium-Ion.
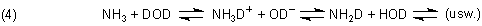
Die Analyse der Gemische erfolgt mit Hilfe von Massespektrometern.
Gewinnung von schwerem Wasser
Auf den deutlichen chemischen und physikalischen Unterschieden zwischen den beiden Wasserarten H2O
und D2O beruhen die Verfahren zur Gewinnung von schwerem Wasser. Das betrifft vor allem die Bildungs-
bzw. Spaltungsenergien. So reichert sich das schwere Wasser D2O bei der Wasserelektrolyse an, weil seine
Energie zur Spaltung in die Elemente größer ist als die von leichtem Wasser H2O. Folglich reichert sich
bei kontinuierlich geführten Langzeitelektrolysen das schwere Wasser zunehmend an. Die Ausbeute hängt allerdings
stark von der Auswahl des Elektrodenmaterials ab. Eine weitere Rolle spielt auch noch die Destillation von mit
D2O angereichertem Wasser.
Aus 100 L gewöhnlichem Leitungswasser erhält man auf diese Weise etwa 50 ml D2O. Ein Liter schweres Wasser kostet übrigens 1760 € (2009).
Wofür man schweres Wasser außerdem gebraucht
Neben dem Einsatz zur Untersuchung von chemischen Reaktionsabläufen mit Hilfe von Austauschreaktionen gibt es
noch andere chemische Verwendungsmöglichkeiten. So kann man auch nicht-ionische deuterierte organische Verbindungen wie
Deutero-Methanol CD3OD herstellen. Damit untersucht man z. B. biochemische Prozesse. Aber auch organisch-chemische
Reaktionen werden damit aufgeklärt.
Warum setzt man schweres Wasser als Lösemittel für die NMR-Spektroskopie ein? Da die Kerne seiner Atome (also die von Deuterium 2D und von Sauerstoff 16O) allesamt geradzahlige Nukleonenzahlen aufweisen, besitzen die Atomkerne dieser Isotope keinen mechanischen Drehimpuls und sind deshalb auch kernmagnetisch inaktiv. Schweres Wasser stört folglich die eigentliche NMR-Messung nicht, die ja letztlich auf der Wechselwirkung der Materie mit einem von außen einwirkenden Magnetfeld beruht.
Die weitaus größten Mengen des schweren Wassers benötigt man jedoch in der Kerntechnik. Beispielsweise werden damit Schwerwasserreaktoren gekühlt.
Noch ein Nachtrag
Durch Elektrolyse von schwerem Wasser (Deuteriumoxid) gewinnt man größere Mengen an Deuterium D2.
Mit dem kann man das dem Lithiumhydrid (LiH) analoge Lithiumdeuterid (LiD) herstellen. Dazu muss man
Lithium nur in einer Atmosphäre von Deuterium auf 500-600 °C erhitzen. Die auf diese Weise aktivierte Reaktion ist exotherm.
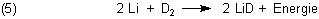
Lithiumdeuterid LiD ist wie LiH ein salzartiger Feststoff. Es ist für die Herstellung von thermonuklearen Waffen („Wasserstoffbomben“) von zentraler Bedeutung. Bei deren durch eine „klassische“ Plutoniumbombe aktivierten Explosion läuft in summa die folgende, extreme Energiemengen freisetzende Kernfusion (Kernverschmelzung) ab:
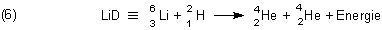
Hierbei spielt auch Tritium eine zentrale Rolle.
Weitere Texte zum Thema „Wasser“