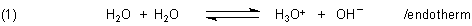
Die Eigendissoziation von Wasser. Das Ionenprodukt
Wasser ist ein typischer Ampholyt, also ein Stoff, der zugleich entsprechend der Brönstedschen Theorie Säure und Base ist. Unter anderem reagieren auch Wassermoleküle miteinander („Wasser reagiert mit Wasser“). Man spricht von der Eigendissoziation des Wassers.
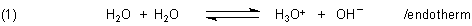
Die Reaktionsenergie DH0 beträgt 56,61 kJ/mol
H2O. Sie entspricht in etwa der Neutralisationsenergie (55,9 kJ/mol H2O), die man z. B.
bei der Reaktion zwischen NaOH und HCl ermittelt.
Die Dissoziationskonstante formuliert man jedoch für diese Reaktion:

Diese Gleichgewichtskonstante KD ist bei 25 °C:
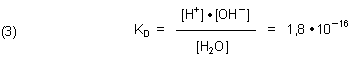
(Die Konzentrationssymbole stehen streng genommen für die dimensionslosen Aktivitäten.)
Der Dissoziationsgrad des Wassers beträgt bei 25 °C nur 1,8 ·10-9. Deshalb bleibt die Konzentration des Wassers praktisch konstant.
Statt der Dissoziationskonstante gibt man in der Praxis das
Ionenprodukt des Wassers an
Um das Ionenprodukt zu berechnen, ermitteln wir zunächst die Molzahl von Wasser in einem Liter Wasser: 1 Liter
Wasser wiegt bei 25 °C 997 g.
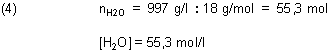
Es gilt folgende Definition:
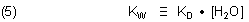
KW ist das Ionenprodukt des Wassers. Daraus folgt als Definition:
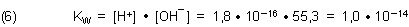
Diese Gleichung (6) gilt nur für 25 °C.
Denn durch Temperaturerhöhung verschiebt man das Dissoziationsgleichgewicht des Wassers in Gleichung (1) auf die rechte Seite, das heißt, dass die Ionenkonzentrationen zunehmen. Damit vergrößert sich auch der Wert des Ionenprodukts. Der Grund ist, dass die Eigendissoziation des Wassers endotherm und somit temperaturabhängig ist. Klicke dazu hier.
Aus Gleichung (6) lässt sich durch Logarithmieren noch eine weitere bekannte fundamentale Beziehung herleiten.
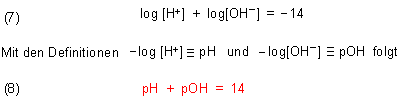
Zu den beiden pKa-Werten des Wassers klicke hier.
Weitere Texte zum Thema „Wasser“