 |
| (Foto: Daggi) |
 |
| (Foto: Daggi) |
Mit Salz kann man Glatteis bekämpfen
Experimente:
Versuch: Mit Salz bekämpft man Eis
Den Effekt der Gefrierpunktserniedrigung nutzt man im Winter, um Glatteis zu schmelzen. Hierzu werden möglichst umweltneutrale Salze (NaCl oder CaCl2-Hydrate) auf das Eis gestreut. Dabei beobachtet man, dass sich festes, scheinbar trockenes Eis verflüssigt. Eis steht nämlich wegen seiner sperrigen Kristallstruktur in einem dynamischen Gleichgewicht mit flüssigem Wasser:
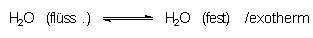
Deshalb ist Eis immer mit einem feinen Flüssigkeitsfilm überzogen.
Gibt man nun Salz hinzu, so beginnt sich dieses unter gleichzeitiger Abkühlung im Wasserfilm
aufzulösen. Denn dazu ist Lösungswärme nötig. Das dem Gleichgewicht entzogene Wasser wird aus
dem Eis ständig nachgebildet. Das Gleichgewicht verschiebt sich somit in die linke Richtung; das
Eis verflüssigt sich zu einer konzentrierten Salzlösung. Dessen Temperatur liegt wegen der
Gefrierpunktserniedrigung weit unter 0 °C. Da das NaCl/Eis-Gemisch
keine tieferen Temperaturen als -21,3 °C ermöglicht, nützt unterhalb dieser Wintertemperatur das
Streuen von Natriumchlorid nichts mehr. Eine Alternative ist das umweltneutralere Calciumchlorid
CaCl2, ein Abfallprodukt der Sodaherstellung
nach Leblanc, da dessen konzentrierte Lösungen erst ab -55 °C gefrieren.
Zum Straßendienst im Winter haben wir einen Tipp des Monats.
Weitere Texte zum Thema „Wasser“