
7 Verfahren zur Stofftrennung
Zur Untersuchung und Charakterisierung von chemischen Stoffen oder um Schadstoffe aus dem betroffenen Medium zu entfernen, bedarf es spezifischer Trennungsverfahren. Ziel ist die Isolierung eines Stoffes oder einer Stoffgruppe.
So ist beispielsweise die Dioxinanalyse deswegen so teuer, weil die Dioxine bzw. Dibenzofurane in geringster Konzentration in einem Gemisch vielfach konzentrierterer CKW wie Hexachlorbenzol (HCB) vorliegen. Deshalb muss man die Boden- oder Fettproben zur Aufkonzentrierung zunächst viele Male extrahieren. Anschließend werden die Dioxine gelchromatographisch von den anderen CKW abgetrennt, also isoliert und dabei weiter angereichert. Erst dann können die ca. 210 Dioxine gaschromatographisch weiter aufgetrennt und bestimmt werden. Nun lässt sich auch das toxische Äquivalent der Dioxine (der TE-Wert) berechnen.
Vollständige Entfernung von Fremdstoffen ist nicht möglich, da die Reinigungsprozesse exponentiell verlaufen (-> 10). Im Allgemeinen nennt man einen Stoff dann rein, wenn er mit entsprechenden Verfahren nicht mehr nachzuweisen ist oder die Reaktion, bei der er Verwendung findet, durch Reste anderer Stoffe nicht gestört wird (-> Tab. 9). Besonders empfindlich sind biochemische Nachweise. Lösemittel für spektroskopische Untersuchungen dürfen im gewählten Strahlungsbereich nicht absorbieren.

| Tab. 9: Die wichtigsten Reinheitsklassen |
|
Einige für die Umweltanalytik und -technologie wichtige Trennverfahren sollen hier kurz aufgelistet werden. Dabei werden physikalische und chemische Trennmethoden unterschieden.
7.1 Physikalische Trennungsverfahren
Hierbei wird der abgetrennte Stoff nicht verändert. Beispiele sind:
Manuelles oder mechanisches Sortieren
Sortieren von Recycling-Glas nach Farbigkeit oder von Kunststoffmüll nach Sorten.
Magnetisches Sortieren
Abtrennen der ferromagnetischen Metalle Eisen, Kobalt und Nickel
aus Schrott oder aus Müll vor dessen Verbrennung in einer MVA.
Kurzzeitmagnetisierung zur Abtrennung von Aluminium.
Siebe und Rechen
Entfernen von Zigarettenfiltern aus dem Klärwasser.
Filter
Mechanische Trennung von heterogenen Gemischen.
Windsichter
Trennen von unterschiedlich dichten Komponenten heterogener
Gemische (z. B. Kunststoff aus dem Autoschrott).
Sedimentieren
Absitzenlassen von gröberen Bestandteilen einer Aufschlämmung
(Trennbecken in der Kläranlage). Phasentrennung von Flüssigkeiten
unterschiedlicher Dichte. Trennen von Kunststoffen in verschiedenen
Flüssigkeiten unterschiedlicher Dichte.
Zentrifugieren
Trennung aufgrund unterschiedlicher Schwere durch ein künstliches
Schwerefeld (Beschleunigung der Sedimentation).
Dialyse
Abtrennen kleinerer Moleküle von großen Molekülen längs einer
halbdurchlässigen Membran. Beispiele sind Salz aus einer Proteinlösung, Alkohol
aus Bier und Trennung der Gase der Luft. Das Verfahren dient auch zur Blutwäsche
bei Nierenversagen; hier werden aus dem Blut Harnstoff, Ammonium-Ionen und andere,
in großen Mengen toxische Stoffe abgetrennt.
Reverse Osmose
Bringt man Reinwasser über eine semipermeable Membran, die nur
Wassermoleküle durchlässt, mit Salzlösungen in Kontakt, so
wandern Wassermoleküle aus dem Reinwasser in die konzentriertere Lösung
(-> Abb. 19a). Dabei baut sich in der konzentrierten
Lösung ein Druck auf (osmotischer Druck).
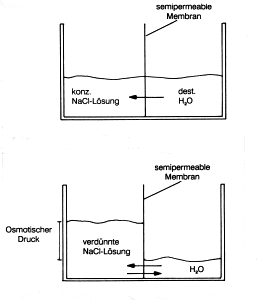
Abb. 19a: Entstehen von osmotischem Druck
Setzt man dagegen die Salzlösung unter Druck,
so kehrt sich der Vorgang um. Nun läuft das Lösemittel durch die semipermeable
Membran in Richtung Reinwasser (-> Abb. 19b). Dies ist ein
wichtiges Verfahren zur Meerwasserentsalzung.
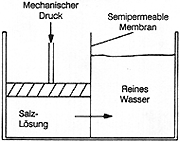
Abb. 19b: Reverse Osmose
Flotation
Schwer trennbare Gemische wie Kohle, Schwefelkies (Pyrit,
Markasit FeS2) und Gangart werden feingemahlen und in Wasser
unter Zusatz von Detergentien aufgeschlämmt. Man bläst Luft durch
diese Mischung. Im Schaum sammelt sich die von Wasser schwer benetzbare
Kohle und wird abgetrennt. Auf gleiche Weise entfernt man den
Ruß beim Papierrecycling.
Adsorption
Beispiele sind Aktivkohlefilter (-> 7.3), bestimmte Silicate (Kieselgel)
oder Aluminiumoxid Al2O3. Von Bedeutung ist auch
keramisches Material (Autoabgas-Katalysatoren). Die Bindungskräfte sind
physikalischer oder schwach chemischer Natur.
Chromatographische Verfahren
Trennung von Gemischen aufgrund ungleicher Verteilung zwischen
einer stationären Phase (im Allgemeinen ein Festkörper) und einer
beweglichen Phase (Gas oder Flüssigkeit). Danach unterscheidet
man:
Extrahieren
Ausschütteln eines Stoffes aus einer Lösung oder festen Mischung
mit einem anderen, mit dem ersten nicht mischbaren Lösemittel.
(Phenol wird aus belasteten Wässern mit Benzol oder Diisopropylether
extrahiert. Coffein wird aus Kaffeebohnen mit überkritischem CO2
unter hohem Druck entfernt.)
Mitfällung, Flockung
Mitreißen von organischen Kolloiden durch Fällung von Gelen wie
Aluminium- oder Eisenhydroxid, aber auch Polysaccharide wie Guar
und Celluloseether.
Einfrieren und Zerschlagen
Gummireifen werden mit flüssigem Stickstoff auf 196 °C
abgekühlt. Das nunmehr glasartig spröde Gummi wird zersplittert
und gemahlen, die Karkassematerialien wie Nylon und Stahldrähte
werden als weiteres wertvolles Recyclinggut abgetrennt.
Destillation
Trennung von Flüssigkeitsgemischen, deren Komponenten verschiedene Siedepunkte
haben. Beispiele sind die Alkoholgewinnung aus Gärmaterial sowie das
Lösemittelrecycling.
Fraktioniertes Kristallisieren
Trennung von Natriumchlorid NaCl und Natronlauge NaOH bei der
Elektrolyse wässriger Salzlösungen aufgrund der schlechteren
Löslichkeit von Natriumchlorid durch Eindampfen der Lösungen.
(Bildung von Salzlagern: Magnesiumchlorid liegt über Kaliumchlorid, dies
über Natriumchlorid.)
Sublimation, Gefriertrocknung
Trennung von Gemischen, von denen Komponenten sublimieren.
7.2 Chemische Trennungen
Hierbei wird der abzutrennende Stoff teils irreversibel chemisch verändert. Es gibt sehr viele Verfahren, von denen hier nur einzelne exemplarisch dargestellt werden sollen.
Verbrennen von Bestandteilen (Oxidation)
Auflösen einer Komponente durch eine Säure, Lauge oder Komplexierung
Elektrolyse
Ionenaustausch
Fällung
Biologische Abtrennung
Verfahren zur Abgasreinigung
7.3 Informationen zur Aktivkohle
Aktivkohlen sind porenreiche, feinkristalline bis amorphe Kohlearten mit adsorptiven Eigenschaften vor allem gegenüber unpolareren Stoffen. Früher stellte man sie durch Erhitzen von Blut, Rohrzucker oder Holz her. Heute ist das Ausgangsmaterial dazu eher Braunkohle. Zur oxidativen Vergrößerung der adsorptiven Oberfläche ("Aufrauung") lässt man die Kohle mit Wasserdampf, Sauerstoff oder Kohlendioxid unter hohem Druck und erhöhter Temperatur reagieren. Ein Teil des Kohlenstoffs bildet dabei Kohlenmonoxid CO, ein Gas, das zur Gewinnung von Prozesswärme weiter verbrannt werden kann. Zur Vermeidung von Sinterung mischt man dem Rohmaterial vor dem Erhitzen leicht herauslösbare anorganische Salze wie Zinkchlorid ZnCl2 bei.
In dieser Weise aktivierte Kohlen besitzen adsorptiv wirksame Oberflächen bis zu 1000 m2/g bei Kapillardurchmessern von 1 - 5 nm. Sie können bis zu 50 % ihrer Masse an Fremdsubstanzen (meist organische Stoffe) aufnehmen. Diese werden vor allem über van der Waals-Bindungen fixiert. Eine besondere Rolle spielen Aktivkohlefilter bei der Reinigung von Klärwasser, da sie besonders gut Farbstoffe, CKW und Pestizide aus dem Trinkwasser zu entfernen vermögen. Nach vollständiger Belegung der Oberfläche können sie durch Ausspülen mit anderen Lösemitteln oder durch Erwärmen regeneriert werden.
Erfolgt zusätzlich eine chemische Umsetzung des adsorbierten Stoffs, so spricht man von Chemisorption. Ein Beispiel ist die reversible oxidative Fixierung von Schwefeldioxid SO2, ein wichtiges Verfahren zur Entschwefelung von geringeren Abgasmengen:

Hierbei spielt Aktivkohle zugleich die Rolle eines Katalysators (-> 12).