Die Untersuchung der Säure/Base-Gleichgewichte der Ascorbinsäure
Experimente:
Versuch: Der Säurecharakter der Ascorbinsäure
Versuch: Die Säure/Base-Titrationskurve der Ascorbinsäure
Vitamin C schmeckt sauer. Magnesium zersetzt es unter Wasserstoff-Entwicklung.
Tropft man es auf Kalkpulver, entsteht Kohlenstoffdioxid. Mit pH-Papier gibt es eine
Rotfärbung. Vitamin C trägt zu Recht die Bezeichnung "Ascorbinsäure". Welche
funktionelle Gruppe ist für die Säurewirkung verantwortlich? Es ist die
Endiol-Gruppe.
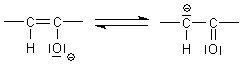
Enole sind Säuren, da sie (obwohl sie Alkohole zu sein scheinen) Protonen abgeben können. Denn das Enolat-Anion ist mesomeriestabilisiert und befindet sich somit auf besonders niedrigem energetischen Niveau.

Man bezeichnet Enole als vinyloge Carbonsäuren. Die Analogie zeigt die folgende Skizze.
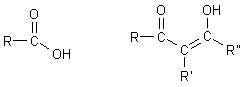
Da hier an dem Vinylteil noch ein elektronenziehender Substituent sitzt, der zudem noch eine Wasserstoffbrücke ausbilden kann, nämlich die zweite Hydroxylgruppe, ist die Ascorbinsäure mit pka1 = 4,17 sogar eine stärkere Säure als Essigsäure (pKa = 4,75).
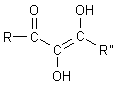
Endiole wie die Ascorbinsäure sind sogar zweibasige Säuren des Typs AH2:
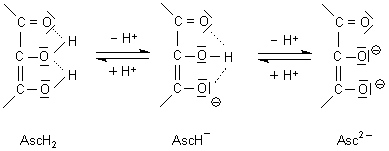
Damit hat die Ascorbinsäure auch zwei pK-Werte: pK1 = 4,17; pK2 = 11,79.
Der für Enole niedrige erste pK-Wert ist ebenfalls die Folge einer Stabilisierung des Anions durch Mesomerie, die diesmal allerdings drei Kohlenstoff-Atome umfasst:
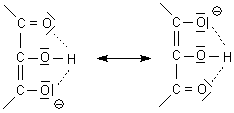
Die große pK-Wertdifferenz resultiert aus dieser Stabilisierung der amphoteren Form AH- durch Wasserstoffbrückenbindung; weiter erschwert auch die negative Ladung die Ablösung des zweiten Protons.
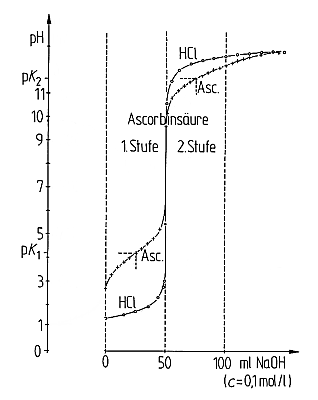
Säure/Base-Titrationskurve von Ascorbinsäure und Salzsäure im Vergleich.
Bedingungen siehe Versuch
Eine Anmerkung zur pK-Wertbestimmung der Ascorbinsäure
Die pK-Wertbestimmung erfolgt durch potentiometrische Säure/Base-Titration.
Zur Auswertung trägt man nach der Titration in einem Diagramm die
gemessenen pH-Werte gegen die ml-Zahl der Natronlauge auf (-> Bild). Während der
erste pK-Wert als Wendepunkt bei 25 ml gut zu erkennen ist, trifft dies nicht für den
zweiten bei 50 ml zu erwartenden pK-Wert zu. In diesem pH-Bereich überdeckt die
zweite Stufe des Dissoziationssystems Wasser (H3O+ / H2O /
OH-) diese Dissoziationsstufe der Titrationskurve der Ascorbinsäure. Um dennoch die
Abweichung von der Titrationskurve des Wassersystems zu erkennen, wird zum
Vergleich Salzsäure mit Natronlauge titriert; die Messergebnisse werden zusammen mit
der der Titration von Ascorbinsäure in dasselbe Diagramm gezeichnet.
Vergleich mit Fumarsäure und Maleinsäure
Ähnliche Verhältnisse liegen bei den ungesättigten Dicarbonsäuren vor: Bekannte
Beispiele sind die isomeren ungesättigten Dicarbonsäuren Fumarsäure und Maleinsäure
(-> Versuch).
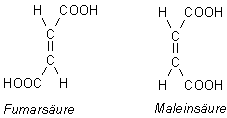
Während die Maleinsäure (wie auch die Ascorbinsäure) intramolekulare Wasserstoffbrücken ausbilden kann, trifft dieses nicht für die transkonfigurierte Fumarsäure zu. Erstere hat deshalb die große pK-Wert-Differenz (pK1 = 1,87; pK2 = 6,1), letztere eine kleine (pK1 = 3,03; pK2 = 4,4).
Weitere Texte zum Thema „Ascorbinsäure“