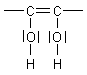
Die Endiol-Gruppe
Diejenige funktionelle Gruppe, die für die Protonen- sowie Elektronenabgabe als typische Reaktionen der Ascorbinsäure verantwortlich ist, ist die Endiolgruppe an den Kohlenstoff-Atomen 2 und 3.

Sie ist zumindest bei der technischen Ascorbinsäure-Synthese das Produkt der Keto-Enol-Tautomerie der L-2-Keto-gulonsäure.
Typisch für Endiole ist zunächst der saure Charakter. Die Ursache der
Protonenabgabe ist, dass sich dabei ein mesomeriestabilisierter Zustand ausbildet, der
zudem durch eine Wasserstoffbrücke gestützt wird. Hierüber berichten wir auf einer
gesonderten Webseite zu den Säure/Base-Reaktionen.
Die andere typische Eigenschaft ist die reduzierende Wirkung. Auch hierbei wirkt sich
die Elektronenhäufung des Endiols und vor allem des Endiolat-Anions verstärkend
aus: Redoxreaktionen.
Als Nachweis von Enolen gilt die Rotfärbung bei Zugabe von Eisen(III)-chlorid-Lösung. Das gelingt zum Beispiel gut mit der Acetessigsäure. Diese Komplexierungsreaktion lässt sich bei dem Endiol der Ascorbinsäure jedoch nicht zeigen, da letztere Eisen(III)-Ionen sofort zu Eisen(II)-Ionen reduziert. Man beobachtet folglich statt der erwarteten Rotfärbung eine Aufhellung der gelben Eisenchlorid-Lösung.
Gleiches gilt für den Nachweis der Doppelbindung. Die Entfärbung von alkalischer Kaliumpermanganat-Lösung (Baeyer-Probe) resultiert aus der Oxidation der Ascorbinsäure, wobei ein Abbau bis zu Kohlenstoffdioxid erfolgt.
Bei der Entfärbung von Bromwasser läuft statt der Addition von Brom die Oxidation zur Dehydroascorbinsäure und somit die Reduktion des Broms zu Bromid ab.
Es wird immer wieder gefragt...
… ob nicht auch die Ascorbinsäure wie die zugrunde liegende Keto-Gulonsäure ein Keto-Enol-Tautomerie-Gleichgewicht
zeigt. Das ist nicht der Fall.
Grund: Eine Keto-Enol-Tautomerie der Endiol-Gruppe hätte den Wechsel der Bindungshybrid-Symmetrie der C-Atome 2 oder 3 von trigonal-planar (sp2) nach tetraedrisch (sp3) zur Voraussetzung, was wegen der Einbindung der beiden C-Atome in den fast planaren fünfatomigen Lactonring energetische Probleme hervorrufen würde. Deshalb liegt die Ascorbinsäure ausschließlich als Endiol vor.
Weitere Texte zum Thema „Ascorbinsäure“