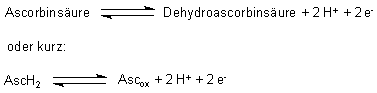
Elektronenübertragungsreaktionen der Ascorbinsäure
Experimente:
Versuch: Qualitative Demonstration der Reduktionskraft von Ascorbinsäure
Versuch: Die katalysierte Synthese von Dehydroascorbinsäure
Versuch: Potentiometrische Titration der Ascorbinsäure mit Kaliumhexacyanoferrat(III)
Versuch: Potentiometrische Titration der Ascorbinsäure mit Silbernitrat
Versuch: Potentiometrische Titration der Ascorbinsäure mit Bromat
Versuch: Bestimmung von Ascorbinsäure mit Tillmanns Reagenz
Versuch: Quantitative Bestimmung von Ascorbinsäure mit Kaliumiodat
Versuch: Nachweis von Vitamin C mit Fehling-Lösung
Versuch: Nachweis von Vitamin C mit Benedict-Reagenz
Versuch: Nachweis von Vitamin C neben reduzierenden Zuckern
Versuch: Nachweis von Vitamin C mit Lugol-Lösung
Die herausragendste Eigenschaft der Ascorbinsäure ist ihr stark ausgeprägtes
Reduktionsvermögen. Das Redoxgleichgewicht wird durch folgende Gleichung
beschrieben:
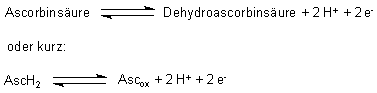
Bei der Formulierung der Redoxreaktion empfiehlt es sich, nur die für die Redoxaktivität notwendige Endiolgruppierung zu schreiben:
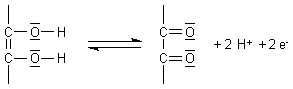
(Auf mögliche - radikalische - Zwischenstufen soll hier nicht eingegangen werden.)
Das Standard-Redoxpotential (bezogen auf Wasserstoff) für das Paar Dehydroascorbat/Ascorbat ist
E0 = +0,06 V bei pH = 7 und 25 °C.
(Zum Vergleich: das Redoxpotential einer entsprechenden Wasserstoffelektrode beträgt -0,41 V.)
Das Redoxpotential ist noch abhängig vom pH-Wert. Die anderen Werte lassen
sich anhand der Nernstschen Gleichung berechnen.
Es gibt viele Oxidationsmittel für die Ascorbinsäure
Die Reduktionskraft von Ascorbinsäure lässt sich mit vielen Oxidationsmitteln
demonstrieren (-> Versuch). Beispiele sind:
KMnO4 besitzt eine so große Oxidationskraft, dass auch die zunächst gebildete Dehydroascorbinsäure unter Fragmentierung des Kohlenstoffgerüsts bis zu Kohlenstoffdioxid abgebaut wird.
Mit Ascorbinsäure lassen sich viele bekannte Reduktionsproben zum Zuckernachweis schon bei Raumtemperatur durchführen, so dass man damit Ascorbinsäure und reduzierende Zucker in Obst unterscheiden kann. Das gilt vor allem für die Fehlingsche Probe sowie Benedict-Probe oder für die Probe mit ammoniakalischer Silbernitratlösung.
Davon zu unterscheiden ist die Rolle des Kupfersulfats bei der Oxidation von Ascorbinsäure zur Herstellung von Dehydroascorbinsäure. Bei den Proben nach Fehling und Benedict wirken die Kupfer(II)-Ionen als Oxidationsmittel; das erfordert alkalisches Milieu. Die Oxidation von Ascorbinsäure mit Sauerstoff läuft auch schon im Sauren ab; vorausgesetzt ist die Anwesenheit von katalytisch wirkenden Cu(II)-Ionen. Diese werden deshalb auch nicht zu rotem Cu(I)-oxid/hydroxid umgesetzt.
Mit einigen dieser Oxidationsreaktionen kann ohne großen Aufwand die Konzentration von Vitamin C bestimmt werden. Hierzu gehören
Hierbei erfolgt die Messung am besten durch potentiometrische Titration.
Mit lodatlösungen lassen sich visuelle Bürettentitrationen durchführen, da überschüssiges Iodat mit dem bei der Oxidation von Ascorbinsäure gebildeten Iodid freies Iod bildet. Damit ist das Titrationsende hervorragend zu erkennen. Ähnliches gilt auch für die Bromometrie, also die Titration mit Bromat.
Weitere wichtige Oxidationsmittel, die ebenfalls zur quantitativen Bestimmung genutzt werden, sind organisch-chemische Redox-Farbstoffe, welche durch Ascorbinsäure in ihre farblosen Leukoverbindungen überführt werden. Bekannte Beispiele sind
Weitere Texte zum Thema „Ascorbinsäure“