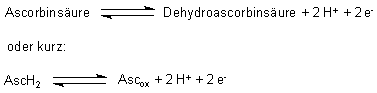
Das Redoxpotential der Ascorbinsäure ist abhängig vom pH-Wert
Experimente:
Versuch: Die simultane Redox- und Säure/Base-Titration der Ascorbinsäure
Versuch: Potentiometrische Titration der Ascorbinsäure mit Kaliumhexacyanoferrat(III)
Versuch: Potentiometrische Titration der Ascorbinsäure mit Silbernitrat
Vitamin C ist umso instabiler gegenüber Sauerstoff, je weniger sauer oder je
alkalischer seine Lösung wird. pH-Wert und Redoxpotential der Ascorbinsäure
bedingen einander also. Das liegt daran, dass am Redox-Gleichgewicht der
Ascorbinsäure Protonen beteiligt sind. Werden die Protonen entfernt, so verschiebt
sich das Gleichgewicht in Richtung auf die Oxidation.
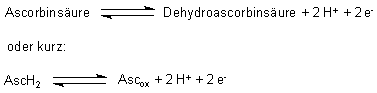
Das Standardpotential bei pH = 7 und 25 °C beträgt (je nach Literatur) E0 = +0,06 V bis +0,08 V.
Hierfür gilt die Nernstsche Gleichung in der folgenden Form:
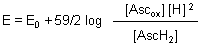
Den Bruch im Logarithmus nehmen wir auseinander.
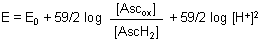
Mit der bekannten Definition pH = - log [H+] wird aus der o. a. Gleichung:
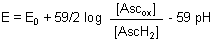
Mit steigendem pH-Wert nimmt also das Redoxpotential der Ascorbinsäure ab. Das bestätigt ja auch unsere Erfahrung.
Um die gegenseitige Abhängigkeit von pH-Wert und Redoxpotential zu demonstrieren, misst man bei der Säure/Base-Titration der Ascorbinsäure mit Natronlauge simultan das Redoxpotential der Lösung (-> Versuch).
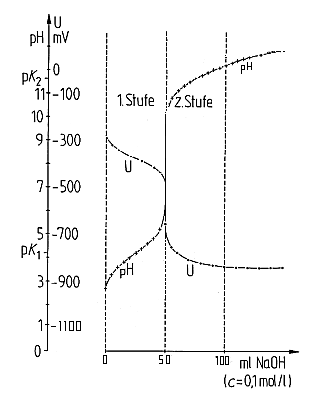
Titration von Ascorbinsäure mit Natronlauge mit simultaner Redox-Messung
Mit zunehmendem pH-Wert steigt das Reduktionsvermögen der Ascorbinsäure
deshalb an, weil die dissoziierte Ascorbinsäure leichter Elektronen aus
nichtbindenden Orbitalen abzugeben vermag als ein Molekül, dessen Elektronen
sich im Molekülorbital zwischen Sauerstoff- und Wasserstoff-Atom aufhalten.
Es ist folglich nicht überraschend, dass bei der Säure/Base-Titration das
Redoxpotential einen ähnlichen Verlauf zeigt wie der pH-Wert.
Die hier vorgestellte Redox-Kurve darf aber nicht mit den klassischen
Redox-Titrationskurven, die man bei Zugabe eines
Oxidationsmittels erhält, verwechselt werden! Bei denen bleibt die Zahl der Protonen
des Ascorbinsäuresystems konstant und die Konzentration der Elektronen nimmt ab.
Hier ist es umgekehrt: Die Zahl der Protonen des Ascorbinsäuresystems nimmt ab, die Zahl der
Elektronen bleibt konstant.
Da bei Zugabe von Oxidationsmittel die frei werdenden Protonen den pH-Wert ins Saure
verschieben (-> Versuch), verändert sich entsprechend der
Nernstschen Gleichung bei Redox-Titrationen natürlich auch kontinuierlich das Redoxpotential
der Lösung. Das stört aber nicht das Erkennen des ausgeprägten Äquivalenzpunkts. Wenn man aber
sicher gehen will, arbeitet man mit Säure/Base-Puffern ausreichender Kapazität. Das ist aber
für die üblichen Redox-Titrationen nicht notwendig. Wir machen das nur einmal am Beispiel
der Titration mit Hexacyanoferrat(III) (-> Versuch).
Die pH-Abhängigkeit des Redoxpotentials der Ascorbinsäure hat weiter zur Folge, dass diese Säure im Bereich um ihre pK-Werte gleichzeitig als pH- und als Redoxpuffer eingesetzt werden kann.
Weitere Texte zum Thema „Ascorbinsäure“