Zur Redoxtitration der Ascorbinsäure mit Tillmanns Reagenz
Experimente:
Versuch: Nachweis von Vitamin C mit Tillmanns Reagenz
(DCPIP); Indikatoreigenschaften von DCPIP
Versuch: Quantitative Bestimmung von Ascorbinsäure mit Kaliumiodat
Eine der bekanntesten quantitativen Nachweismethoden der Ascorbinsäure ist die
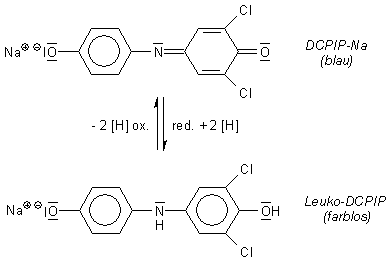
Titration mit Tillmanns Reagenz, chemisch das Natriumsalz von 2,6-Dichlorphenol-indophenol
(abgekürzt im Laborjargon DCPIP) (-> Versuch). Dessen
Lösung ist tiefblau gefärbt.
Durch die Ascorbinsäure wird das DCPIP zu einer farblosen Verbindung ("Leukoverbindung";
griechisch leukos, weiß) reduziert. Bei dieser Titration ist also
ein deutlicher Farbumschlag zu erkennen.

Die Redoxreaktionsgleichung lautet deshalb:
AscH2 + DCPIP ———> Ascox + DCPIPH2
Ein Mol DCPIP entspricht somit einem Mol Ascorbinsäure.
Die quantitative Titration von Ascorbinsäure mit Tillmanns Reagenz ist sehr schwierig. Das liegt vor allem daran, dass man keine exakte Einwaage von DCPIP zustande bringt. Da auch die Lösungen von DCPIP nicht allzu stabil sind, ist es üblich, vor der Titration ihren Titer anhand einer AscH2-Eichlösung zu ermitteln.
Erschwerend kommt hinzu, dass DCPIP ein Säure/Base-Indikator ist. Im sauren Milieu ist er hellrot und im basischen Milieu blau.
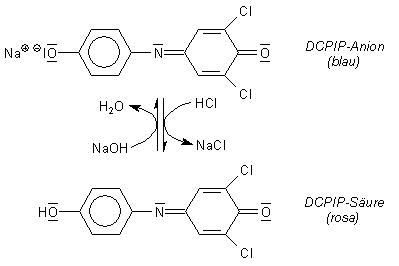
Deshalb bildet DCPIP bei Zugabe zu einer sauren Ascorbinsäurelösung zunächst
die hellrosa Säure, aus der heraus die Reduktion zur farblosen Leukoverbindung
erfolgt.
Dabei ist weiter zu beachten, dass DCPIP als Schiffsche Base im Sauren nicht
stabil ist, so dass seine Moleküle in zwei Teile zerfallen.

Deshalb ist der Umschlagspunkt schwer zu erkennen. Man umgeht das, indem man eine überschüssige Menge an DCPIP-Lösung mit bekannter Konzentration zur Probelösung gibt. Ein Teil davon wird von der Ascorbinsäure verbraucht. Dann stellt man die Lösung schwach alkalisch ein, wodurch die blaue Farbe des überschüssigen DCPIP wieder gut erkennbar wird. Diese Lösung titriert man mit einer bekannten Lösung von Ascorbinsäure zurück. Insgesamt ist Ungeübten von der quantitativen Titration mit DCPIP abzuraten. Stattdessen eignet sich die Titration mit Iodat.
Die Leukoform von DCPIP lässt sich übrigens wieder oxidieren - wie die obige Reaktionsgleichung zeigt. Als Oxidationsmittel dient Wasserstoffperoxid. Dazu stellt man die Lösung zunächst neutral ein und tropft dann nicht zuviel H2O2 zu und vermischt gut. Die Reaktion dauert etwas. Aber nach wenigen Minuten beobachtet man, dass die farblose Lösung wieder blau wird.
DCPIPH2 + H2O2 ———> DCPIP + 2 H2O
Als Oxidationsmittel kann man auch etwas Bleidioxid (PbO2) zugeben.
DCPIPH2 + PbO2 ———> DCPIP + PbO + H2O
Weitere Texte zum Thema „Ascorbinsäure“