Ascorbinsäure und das Oxidationsmittel Silbernitrat
Experimente:
Versuch: Qualitative Demonstration der Reduktionskraft von Ascorbinsäure
Versuch: Titration der Ascorbinsäure mit Silbernitrat
Bei Zugabe von ammoniakalischer Silbernitratlösung zu Ascorbinsäure fällt spontan
Silber aus (-> Versuch). Dies ist die Abwandlung der
Silberspiegelprobe auf reduzierende Zucker.
Die Reaktionsgleichung des Redoxprozesses ist
AscH2 + 2 Ag+ ———> Ascox + 2 Ag + 2 H+
Sie lässt erwarten, dass zur quantitativen Oxidation von Ascorbinsäure zwei Äquivalente an
Silbernitrat notwendig sind; dafür werden zwei Äquivalente an Wasserstoff-Ionen
freigesetzt.
Um das zu zeigen, titrieren wir die Ascorbinsäurelösung mit Silbernitratlösung, ohne
Ammoniak zuzusetzen. Da die zugegebene Silbernitratlösung mehr oder weniger neutral
reagiert, sollte sich deshalb während der Titration nicht nur der Spannungswert,
sondern auch der pH-Wert ändern. Das wird durch den Versuch
bestätigt.
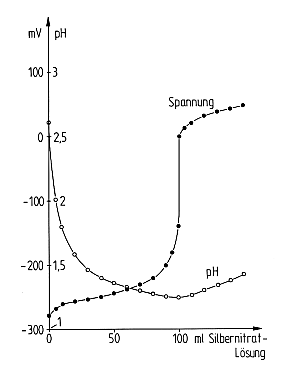
Das folgende Bild zeigt die Verläufe von Spannung und pH-Wert bei Zugabe des
Titriermittels, entsprechend unseren Versuchsbedingungen. Nach dem
Äquivalenzpunkt nimmt der pH-Wert wieder zu; Grund ist die Verdünnung der
vorliegenden Säure durch überschüssige Silbernitratlösung.

Nach diesen Versuchen überrascht es nicht, dass man früher Ascorbinsäure auch als
Weitere Texte zum Thema „Ascorbinsäure“