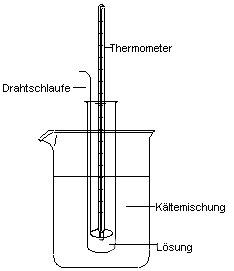
Versuch: Gefrierpunktserniedrigung von Salzlösungen
Schülerversuch; 15 min.
Beim Experimentieren den Allgemeinen Warnhinweis unbedingt beachten.
Geräte
Reagenzglas, Thermometer (möglichst genau, Messbereich um 0 °C), Draht,
Becherglas (400 ml).
Chemikalien und Material
Destilliertes Wasser, Kochsalz und andere Salze, Zucker, Eis.

(Zeichnung von Sven Dittmann)
Durchführung
1 Fülle 10 ml destilliertes Wasser in ein
Reagenzglas. In dieses Glas stellst du ein
Thermometer. Um das Thermometer biegst du aus dem Draht eine Schlaufe mit einem
lang auslaufenden Ende, das aus dem Reagenzglas herausragt und das dir das
Rühren des Wassers durch Auf- und Abwärtsbewegung erlaubt. Prüfe die Gängigkeit
dieser Anordnung.
Bereite nebenher eine Kältemischung vor (-> Versuch
189).
Stelle das Reagenzglas in die Kältemischung, nachdem du die Temperatur des
Wassers abgelesen und notiert hast. Rühre das Wasser durch Auf- und
Abwärtsbewegen des Drahts. Verfolge die Temperatur. Wenn sich der Draht nicht
mehr bewegen lässt, ist das Wasser gefroren. Lies auch diesen Temperaturwert ab.
2 Wiederhole den Versuch mit reinem, destilliertem Wasser, in dem du 2 g Kochsalz aufgelöst hast.
3 Die Temperaturdifferenz zwischen den Gefrierpunkten ist die Gefrierpunktserniedrigung.
Ergebnis
Die Lösung gefriert statt bei 0 °C bei etwa -5 °C.
Hinweis
Du kannst den Versuch mit verschiedenen Salzkonzentrationen wiederholen. Willst du
die Salze vergleichen, musst du Lösungen gleicher Molzahlen zugrundelegen.
Du kannst auch Harnstoff oder Rohrzucker nehmen.