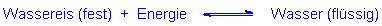Prof. Blumes Tipp des Monats August 1998 (Tipp-Nr. 14)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Mit Kältemischungen gibt es auch im Sommer Eis
Die römischen Kaiser und Napoleon I. von Frankreich hatten außer ihrer Rauflust noch
etwas anderes gemeinsam: Sie schleckten im Sommer gerne gefrorenen Honig oder
gefrorene Sahne. (Unsere leckeren Eiszubereitungen gab es damals noch nicht.)
Wassereis zu beschaffen war nicht schwer: Im Winter, wenn die Seen zugefroren waren, wurde
Wassereis "geerntet". Wie man das machte, wird sehr schön von dem schwedischen Maler Carl
Larsson beschrieben.
Klick mich an!
Bild 1: Eis-Ernte. Ausschnitt aus einem Bild von Carl Larsson
(Aus dem Buch von Carl Larsson: 'Bei uns auf dem Lande' (ISBN 978-3-7845-2745-1).
Mit freundlicher Genehmigung des Verlags Langewiesche Königstein)
Die Eisbrocken wurden regelrecht aus dem zugefrorenen See herausgesägt. Kräftige Pferde mussten die großen Stücke herausziehen. Wenn man fertig war, wurde das Loch mit Tannenzweigen markiert - damit kein anderer hineinfiel. Zur Isolierung wurde das geerntete Eis mit Stroh zugedeckt und auf den Hof oder in die Stadt gebracht, wo es in speziellen Eiskellern aufbewahrt wurde.
Außerdem konnte man auch im Sommer aus den Gletschergebieten des Apennin oder der Alpen Eis besorgen.
Man bewahrte auch den Schnee des Winters auf. Dann gab es im Sommer Eis in speziellen Eisdielen - wie es Prosper Merimée in seiner Novelle "Carmen" beschreibt.
Allerdings wird Sahne erst unterhalb von etwa -20 °C merklich fest. Da die Alten (anders als wir
heute) nicht über Kältemaschinen verfügten, mussten sie einen Trick kennen,
um noch tiefere Temperaturen zu erzeugen. Das machten sie so:
Sie mischten Wasser bzw. Eis mit Salzen. Vor allem nutzten sie
bestimmte Salze, die aus den Kellerwänden ausblühten. Dieser "Salpeter" (also das von den
steinernen Kellerwänden abgekratzte Salz; lat. sal petri) war vor allem Ammoniumnitrat,
ein Relikt aus bakteriell zersetzter Gülle, die aus dem benachbarten Abfluß oder Misthaufen
durch die Kellerwand drang.
Mit diesem Salz ließen sich hochkonzentrierte Lösungen herstellen. Dabei, das hatten die Alten
beobachtet, kühlten die Lösungen stark ab: Mischte man zum Beispiel ein
Gewichtsteil ("Lot") Salpeter mit einem Lot von etwas vorgekühltem Wasser, so erreichten
sie Temperaturen bis zu -5,3 °C (Versuch 1). So konnten sich Napoleons Soldaten sogar mit
Hilfe von Schießpulver, in dem ja Nitrat enthalten ist, beim Feldzug in Ägypten zumindest
eiskalte Getränke zubereiten. (Vorgekühltes Wasser stellten sie her, indem sie es in porösen
Tonkrügen aufbewahrten. Die zum Verdunsten notwendige Verdampfungswärme wurde dem Wasser selbst und dem Krug
entzogen. So erreicht man Temperaturen um +10 °C.) Mischte man außerdem 10 Teile festes Wassereis mit 1,5 Teilen
Salpeter, so erreichte man sogar Temperaturen von -13 °C (Versuch 2)! Und mit einer Mischung
aus Wassereis und Kochsalz (-21,3 °C) gefror sogar die Sahne (Versuch 3).
Was steckt physikalisch-chemisch dahinter?
| - | Mischst du ein Salz in flüssigem Wasser, so löst es sich darin, indem die Wasserdipole die Ionen des Salzes umhüllen und so aus dem Ionengitter herausbrechen. Dieser Vorgang ist normalerweise endotherm, da die freiwerdende Ion-Dipol-Wechselwirkung kleiner ist als die Gitterenergie des Salzes. Die Lösungswärme für das Salz wird daher aus der Umgebung entnommen; Lösung und Gefäß kühlen sich ab (Versuch 1). Mit Natriumnitrat erreichen wir so eine Temperatur von -5,3 °C. |
| - |
Mischst du ein Salz mit festem Wassereis, so löst sich das Salz
ebenfalls auf, auch wenn dies deutlich langsamer geschieht (Versuch 2).
Woher kommt überhaupt das Wasser zum Lösen? Du weißt, dass Eis unter Druck schmilzt, also auch unter der Einwirkung des Luftdrucks. Deshalb ist Eis immer mit einer dünnen Schicht von Wasser überzogen. Mit diesem flüssigen Wasser steht das Eis in einem dynamischen Gleichgewicht.
Das Wasser zum Lösen des Salzes stammt aus diesem Gleichgewicht und wird ständig
nachgebildet. Damit verschiebt sich das Gleichgewicht, und das Eis verschwindet langsam.
(Diesen Effekt nutzt man übrigens auch, um im Winter Glatteis auf Gehwegen und
Straßen zu bekämpfen.)
|

Bild 2: (Foto: Daggi)
Rezepte für Kältemischungen
In der Literatur sind sehr viele Mischungsangaben zu finden. Allerdings weichen die Angaben über Zusammensetzung und
erreichte Temperaturen in verschiedenen Tabellenwerken oftmals stark voneinander ab.
In unserer Tabelle findest du einige Mischungsbeispiele, die du selbst nachprüfen kannst.
Am billigsten ist die Kältemischung mit Kochsalz, bei der du
-21,3 °C erreichen kannst (Versuch 3).
Anstelle von Salzen nimmt man auch nicht-ionische Verbindungen als Zusätze zur
Herstellung von Kältemischungen. Beispiele sind Ethanol und der Harnstoff
(Versuch 4). Letzteren setzt man aus Gründen des Umweltschutzes auch anstelle von Streusalz zum
Bekämpfen von Glatteis ein.
| Kälte-Substanz | Zusammensetzung | Niedrigste erreichbare
Temperatur (°C) |
| NH4Cl | 30 g/100 g Kaltwasser | -5 |
| NaNO3 | 75 g/100 g Kaltwasser | -5 |
| CaCl2 · 6 H2O | 41 g/100 g Eis | -9 |
| KCl | 30 g/100 g Eis | -10,5 |
| Harnstoff | 10 g/100 g Eis | -10,8 |
| NH4NO3 | 14 g/100 g Eis | -13,6 |
| NaNO3 | 15 g/100 g Eis | -13 |
| NH4Cl | 25 g/100 g Eis | -15,4 |
| NH4NO3 | 60 g/100 g Kaltwasser | -16,8 |
| NaCl | 33 g/100 g Eis | -21,3 |
| CaCl2 · 6 H2O | 81 g/100 g Eis | -21,5 |
| NaBr | 66 g/100 g Eis | -28 |
| Ethanol | 105 g/100 g Eis | -30 |
| CaCl2 · 6 H2O | 123 g/100 g Eis | -41 |
| CaCl2 · 6 H2O | 143 g/100 g Eis | -55 |
| KOH | 31 g/100 g Eis | -63 |
| H2SO4 (w = 66 %) | 91 g/100 g Eis | -90 |
| MgCl2 · 6 H2O | 85 g/100 g Eis | -94 |
|
Experimente
1 Natriumnitrat-Wasser-Kältemischung
2 Natriumnitrat-Eis-Kältemischung
3 Natriumchlorid-Eis-Kältemischung
4 Harnstoff-Eis-Kältemischung
|
Rüdiger Blume und Dagmar Wiechoczek
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 20. Januar 2010, Dagmar Wiechoczek