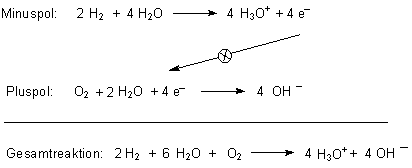
Das Prinzip der Brennstoffzellen
Experimente:
Versuch: Betrieb von Brennstoffzellen
Die gezähmte Knallgasexplosion
Die Verbrennungsreaktion zwischen Wasserstoff und Sauerstoff ist eine Reaktion mit
Elektronenübertragung, auch wenn es auf den ersten Blick nicht so deutlich ist. Die
Wasserstoffatome übertragen je ein Elektron auf Sauerstoffatome. Dabei wird Energie
frei, bestenfalls unter gleichmäßiger Verbrennung, schlimmstenfalls wie bei der
Knallgasexplosion.
Wenn man (wie wir es bei der technischen Anwendung von Elektronenübertragungsreaktionen, nämlich bei den galvanischen Elementen gesehen haben) Elektronenabgabe und -aufnahme an getrennten Orten ablaufen ließe, müsste dazwischen ein elektrischer Strom fließen. Wasserstoff und Sauerstoff müssten ohne Flammenerscheinung und Explosion zu Wasser reagieren. Und das funktioniert tatsächlich in einem galvanischen Element, der Brennstoffzelle. Folgende Redoxvorgänge laufen an den beiden Elektroden, die als Redox-Katalysatoren wirken, ab:
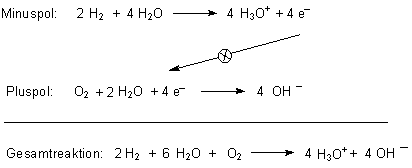
Die Oxonium-Ionen H3O+ und Hydroxid-Ionen OH- reagieren
anschließend zu Wasser. Damit ist die Gesamtreaktion die der bekannten Verbrennung von
Wasserstoff in Gegenwart von Sauerstoff:
2 H2 + O2 ———> 2 H2O /exotherm
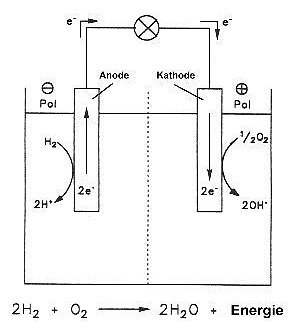
Dieses gerade beschriebene galvanische Element ist die so genannte Knallgaszelle. Hier wird unter Vermittlung von katalytisch wirkenden Elektroden aus Edelmetallen wie Platin der Prozess, der bei einer Verbrennung oder Knallgasreaktion ungebremst abläuft, so fein gesteuert, dass die nahezu gesamte Reaktionsenergie bei der Verbrennung von Wasserstoff nicht als wertlose Wärme frei wird, sondern als hochwertige elektrische Energie abgefangen werden kann. Als Reaktionsprodukt entsteht nur Wasser. Dass man dabei allerdings nur Spannungen um 1,23 V erhält, ist ein gewisser Nachteil, der aber durch geschickte technische Anordnung (z. B. durch Reihenschaltung mehrerer Zellen) ausgeglichen werden kann.
 |
| Brennstoffzelle |
Eine Brennstoffzelle ist somit eine galvanische Zelle, bei der die chemische Energie,
die üblicherweise bei Verbrennungen frei wird, unter katalytischer Mitwirkung des
Elektrodenmaterials direkt in elektrische Energie umgewandelt wird.
Da an den Elektronenübertragungsreaktionen nur Nichtmetalle bzw. deren ungeladene Verbindungen beteiligt sind, sind die Vorgänge an den Elektrodenoberflächen ausschließlich diffusionsbestimmt. Es treten deshalb auch bei stärkerem Stromfluss keine Polarisationen und Grenzschichten auf, die von ionischen Edukten nicht durchwandert werden können. Das führt dazu, dass die energieliefernden Prozesse bei einer Brennstoffzelle über einen weiten Bereich (anders als bei den klassischen galvanischen Elementen wie zum Beispiel dem Bleiakku) nahezu unabhängig von der Stromentnahme sind. Erst wenn die Leistungsanforderungen zu hoch werden, gelangen auch durch Diffusion nicht ausreichend Edukte an die Oberfläche, die Spannung und Leistung der Brennstoffzelle brechen ein.
Ein Problem beim kontinuierlichen Betrieb der Brennstoffzelle ist die Abfuhr des Reaktionsprodukts. Das macht besondere Konstruktionen der Zelle erforderlich. Zum einen trennt man die Reaktionsräume durch eine Kationenaustauscher-Membran ab, die nur für Protonen durchlässig ist. Die Membran spielt also die Rolle des Elektrolyten. Diese Membranbrennstoffzellen werden vor allem in den Autos genutzt. Weiter setzt man auch auf Hochtemperaturbrennstoffzellen, bei denen der Elektrolyt eine feste oder geschmolzene Phase ist, mit der man die die Reaktionsräume elektrisch leitend abtrennt.
Auch andere Brennstoffe sind denkbar
Das Faszinierende ist: Die Brennstoffzelle kann auch mit den klassischen, fossilen
Rohstoffen und mit gasförmiger oder löslicher Biomasse betrieben werden:
Kohlenwasserstoffe wie Erdgas, Butan oder Benzin, ätherische Öle, Biogas, Alkohole
wie Methanol und Ethanol oder sogar Glucose lassen sich hier einsetzen.
Der chemische Ablauf für Methanol als Brennstoff kann beispielsweise so formuliert werden. Dabei sind die Oxidationszahlen der am Redoxvorgang beteiligten Elemente Kohlenstoff und Sauerstoff (rot gekennzeichnet) hilfreich:
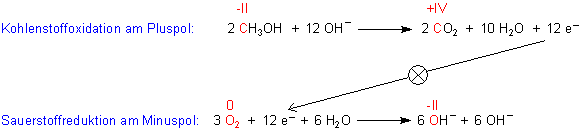
Zum Formulieren der Gesamtreaktion addieren wir die beiden Gleichungen.
2 CH3OH + 12 OH- + 3 O2 + 12 e- + 6 H2O ———> 2 CO2 + 10 H2O + 12 e- + 12 OH-
Wir streichen die auf beiden Seiten stehenden Elektronen und Hydroxid-Ionen weg und gleichen die Anzahl der Wassermoleküle aus. Die Reaktion in einer Brennstoffzelle, die mit Methanol als "Brennstoff" läuft, ist dann formal:
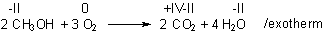
Weitere Texte zum Thema „Auto“