Warum der Motor klopft und was man dagegen tun kann
Experimente:
Versuch: Wie Radikale Kerzenwachs entzünden helfen -
Der chemische Flammenwerfer
Versuch: n-Heptan und i-Octan im Vergleich
Versuch: Verbrennen von Kohlenwasserstoff/Alkohol-Gemischen
Beim starken Erhitzen (also auch schon beim Einspritzen des
Treibstoff-Luft-Gemisches in den heißen Zylinder oder beim adiabaten Komprimieren
von Dieselkraftstoff/Luftgemischen) werden vor allem von Molekülen linearer
Kohlenwasserstoffe H-Atome abgespalten. Die entstehenden Molekülbruchstücke
nennt man Radikale.
CH3-CH2-CH2-CH2-CH2-CH2-CH3 ———> CH3-CH2-CH2-CH2-CH2-CH2-CH2· + ·H
Wasserstoffradikale reagieren besonders leicht mit dem Sauerstoff, und zwar auch ohne Zündung durch eine Zündkerze. Dies zeigt sehr schön der Versuch. Deshalb erfolgt die Verbrennung bereits vor dem Arbeitstakt. Sie verläuft außerdem nicht mehr längs einer von der Zündkerze weg wandernden Flammenfront, sondern setzt an verschiedenen Stellen im Zylinder ein. Dadurch kommt es zum Klopfen und Klingeln, einem typischen Motorgeräusch. Das schädigt den Motor auf die Dauer.

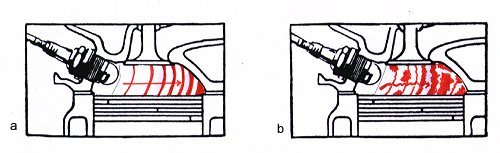
Wanderung der Flammenfront im Otto-Motor
a) Reguläre Verbrennung
b) Klopfen auslösende irreguläre Verbrennung
Gegen das Klopfen kann man zweierlei tun.
| 1. | Man nutzt von vornherein solche Kohlenwasserstoffe als
Treibstoffe oder Treibstoffzusatz, die keine oder weniger Wasserstoffradikale bilden.
Hierzu gehören aromatische Kohlenwasserstoffe, die sog.
BTX-Aromaten (Benzol, Toluol und Xylol-Isomere). Folglich
ist der Aromatenanteil in Superbenzin besonders hoch.
|
| 2. | Man fängt entstandene Wasserstoff-Radikale ab.
Dazu setzt man von vornherein instabile Verbindungen zu, aus denen im heißen
Treibstoff-Luft-Gemisch rasch Kohlenwasserstoff-Radikale entstehen. Beispiele sind die
verzweigten Kohlenwasserstoffe, hier vor allem das Isooctan.
Bei dessen Zerfall bilden sich zwei isomere Butyl-Radikale:
Diese sind gegenüber Sauerstoff viel weniger reaktiv als H·, deshalb relativ stabil und langlebig. Sie überschwemmen den ganzen Verbrennungsraum und reagieren mit den Wasserstoff-Radikalen (bevor diese mit Sauerstoff reagieren können) unter Rückbildung von normal abbrennenden Kohlenwasserstoffen.
Folglich entstehen keine das Klopfen auslösenden irreguläre "Brandnester". Das gleichmäßige Abbrennen des Treibstoff-Luft-Gemischs ist dadurch wieder gewährleistet. Solche Radikalfänger nennt man übrigens Scavenger (engl. Straßenkehrer). Bei der Antiklopfwirkung von Isooctan handelt es sich allerdings um einen komplizierten Mechanismus, der über das simple Einfangen von Radikalen hinausgeht. Das Isooctan ist also besonders klopffest (also zündträge). Besonders stark zum Klopfen neigend (also zündfreudig) ist das n-Heptan. Das äußert sich auch im Brennverhalten der beiden Kohlenwasserstoffe (-> Versuch). Zur Beschreibung der Klopffestigkeit von Treibstoffen hat man die Oktanzahl (OZ) eingeführt. Man hat reinem Octan die Oktanzahl 100 zugeordnet, reinem n-Heptan die Oktanzahl 0. In verbleitem Benzin ist Bleitetraethyl enthalten, das rasch unter Bildung von vier Ethyl-Radikalen (kurz "Ethyl" genannt) zerfällt: Pb(C2H5)4 ———> Pb + 4 ·C2H5 Diese Radikale wirken wieder als Scavenger: C2H5· + ·H ———> C2H6 Aber auch Alkohole wie Methanol fangen äußerst effektiv Radikale ab (-> Versuch): CH3OH + 2 H· ———> CH4 + H2O Bei hohen Temperaturen wirken auch die BTX-Aromaten als Radikalbildner und -fänger. Nun verstehen wir auch, warum gerade Methyl-t-Butyl-Ether (MBE) so ein guter Ersatz für Bleitetraethyl ist: In der Hitze zerfallen dessen Moleküle und bilden die oben angesprochenen Scavenger. CH3-O-C(CH3)3 ———> CH3O· + ·C(CH3)3 |
Radikalbildung begrenzt die Leistungsfähigkeit von
Ottomotoren
Dass die Radikalbildung, also die Selbstentzündung, auch durch Kompression ausgelöst werden
kann, setzt der Konstruktion von Ottomotoren eine obere Grenze. Denn bei zu hoher
Kompression von Benzin setzt das Klopfen durch Selbstentzündung ein.
Würde ein Ottomotor mit Dieselkraftstoff funktionieren können? Die Antwort lautet Nein.
Grund: Dieselkraftstoff verdampft zu wenig, ist schwer entflammbar und neigt außerdem zu
stark zum Klopfen.
Weitere Texte zum Thema „Auto“