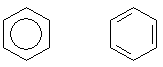
Die grafische Darstellung der Struktur des Benzols
Eine typische Fragestellung lautet: „Wie sieht die Benzolstruktur aus? Welche der folgenden beiden Darstellungsformen ist die richtige?“
Letztlich ist die Benzolstruktur ein exemplarisches Thema für die Diskussion, was ein Modell ist oder kann. Ein Modell ist in unserem Fall eine Darstellung eines sehr kleinen, an sich unsichtbaren Objekts. Dessen Darstellungsform variiert je nach dem jeweiligen Zweck.
Die linke Struktur ist die heute allgemein übliche Darstellungsform. Sie beschreibt die Delokalisierung der 6
p-Elektronen im Grundzustand. Übrigens ist der Ring kreisförmig und nicht oval - weil der
Benzolring ja auch ein völlig in sich symmetrisches Sechseck ist.
Die rechte Kekulé-Struktur ist heute genau genommen eine Darstellung von angeregten Molekülorbitalen. Man nutzt diese graphische Struktur eigentlich nur noch, wenn es um die Darstellung von Reaktionsmechanismen wie z. B. bei Addition oder Substitution am aromatischen Kern geht.
Dass die Kekulé-Strukur ihre Schwächen hat und hinsichtlich der Elektronen ein statisches Bild vermittelt, das nicht gegeben ist, erkennt man spätestens an der bekannten Diskussion zu den ortho-Dibromverbindungen des Benzols. Genau genommen müssen die beiden Strukturen (I) und (II) verschiedene Verbindungen beschreiben - was aber nicht der Fall ist, da es bekanntlich nur ein ortho-Dibrombenzol gibt. Folglich ist die Darstellung (III) mit dem Ring im Benzolkern die bessere Variante.
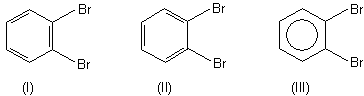
Hier zeigt auch die Darstellung mit den delokalisierten Elektronen ihre Schwächen: Denn das ringförmige Orbital gilt nur
für den nicht substituierten Benzolring. Bekanntlich üben die Benzolatome einen Elektronenzug aus, so dass die Elektronenwolke
verzerrt sein muss.
Aber auch die beim unsubstituierten Benzol ist die Strukturdarstellung mit den delokalisierten Ringelektronen nicht der Weisheit letzter Schluss: Genau genommen gibt es im Grundzustand drei verschiedene p-Orbitale, wie die folgende Skizze zeigt. Denn nach dem Pauli-Prinzip darf es pro Orbital nur zwei Elektronen geben.
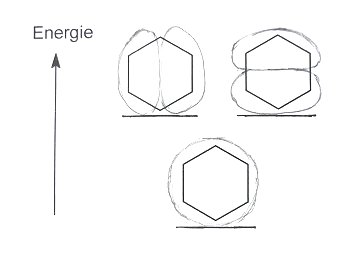
Die drei p-Orbitale des Benzols im Grundzustand
Die „Wahrheit“ am nächsten kommt aber immer noch das mathematische Modell der Benzolstruktur, bei dem auf Anschaulichkeit in
unserem Sinne ganz verzichtet wird.
Weitere Texte zum Thema „Kohlenwasserstoffe“