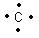
Die Vierbindigkeit des Kohlenstoffs und das EPA-Modell
"Kohlenstoff ist in seinen Verbindungen immer vierbindig" - so findet man es überall zu lesen. Und tatsächlich, im Periodensystem der Elemente ist der Kohlenstoff in der vierten Hauptgruppe zu finden, besitzt also vier Außenelektronen, über die Bindungen zu anderen Atomen eingegangen werden können.
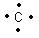
Wie alle Elemente ist auch der Kohlenstoff bestrebt, in seinen Verbindungen die Elektronenanordnung eines Edelgases zu erreichen. Das bedeutet für den Kohlenstoff, 8 Elektronen um sich herum zu scharen. Diese finden, wenn man nach Bohr geht, auch maximal auf seiner Außenschale Platz. Dieses sagt die Oktettregel aus (lat. octo = acht). Um dieses zu erreichen, geht das Kohlenstoffatom Bindungen mit solchen Atomen ein, die selbst ungepaarte Elektronen in die Verbindung mit einbringen.
Typische Bindungspartner sind:
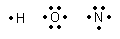
Dazu gehören auch, und das macht den Kohlenstoff so besonders, weitere Kohlenstoffatome.
Ein einzelnes Kohlenstoffatom kann also beispielsweise vier Elektronenpaarbindungen zu vier Wasserstoffatomen eingehen:
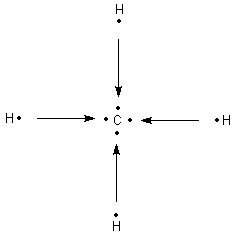
Der Stoff, der dabei entsteht ist das Methan (CH4).
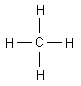
Da Wasserstoff ja nur zwei Elektronen in seiner Schale besitzen kann, nimmt er in diesem Molekül die
Elektronenanordnung des Edelgases Helium ein.
Jedes Elektronenpaar der vier Bindungen hält sich dabei in Räumen zwischen den beiden Atomkernen auf.
Diese kann man sich als eine Elektronenwolke vorstellen.
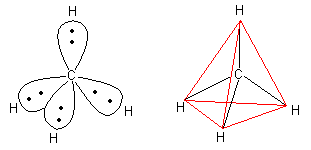
Das Elektronenpaarabstoßungsmodell (EPA-Modell)
Da alle Elektronen eine negative Ladung besitzen, stoßen sich die Elektronenpaare der vier Bindungen
so weit wie möglich voneinander ab. Dieses ist wie bei den gleichnamigen Polen eines Magneten.
Somit muss man das Methanmolekül räumlich betrachten. Dazu gibt es ein Modell.
Wenn man vier Luftballons prall aufpustet und so eng wie möglich miteinander verknotet, kann man
erkennen, dass sich die Ballons gegenseitig so weit wie möglich voneinander wegdrücken. Alle Ballons
nehmen auf diese Weise den größtmöglichen Abstand zueinander ein.

Bild 1 (Foto: Andreas)
Die Form, die die vier Ballons dabei mit ihren Enden aufspannen, ist die eines Tetraeders.
Ebenso stoßen sich die vier Bindungselektronenwolken im Methan ab:
Die Fischer-Projektion
Ist jetzt die Strukturformel für das Methan als Kreuz, wie wir sie oben verwendet haben, falsch?
Gewiss nicht, sie stellt das Molekül eigentlich sogar sehr gut dar. Sie ist nämlich quasi das
Schattenbild des Methantetraeders. Dieses erkennt man, wenn man ein Molekülmodell des Methans mit einem
Overheadprojektor auf die Wand abbildet.


Bild 2 (Fotos: Andreas)
Man spricht von der Fischer-Projektion (benannt nach Emil Fischer,
1852-1919). Die Fischer-Projektion für das Methanmolekül ist ein Kreuz.
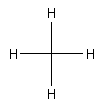
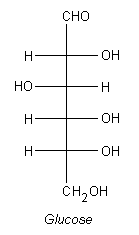
In diesem Kreuz befindet sich in der Mitte das Kohlenstoffatom. Die waagerechten Bindungen zu dem Wasserstoff stehen nach vorne, aus der Ebene heraus. Die Senkrechten laufen hinter die Ebene. Hier ist als weiteres Beispiel das Molekül der Glucose.
Zu den Darstellungsformen der Moleküle von Kohlenwasserstoffen haben wir noch eine weitere Webseite: Schreibweisen der Kohlenwasserstoffe
Weitere Texte zum Thema „Kohlenwasserstoffe“