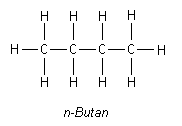
Isomerie der Alkane
Isomere Verbindungen (gr. isos: gleich; meros: Teil) besitzen bei gleicher Summenformel verschiedene chemische und physikalische Eigenschaften.
Ein einfaches Beispiel ist das aus 4 C-Atomen bestehende Butan. Ist dessen Kette unverzweigt, bezeichnet man die Verbindung als n-Butan (n steht für normal).

Sind die vier Kohlenstoffatome jedoch in einer verzweigten Kette angeordnet, spricht man vom Isobutan.
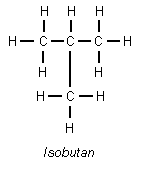
Die Vorsilbe Iso- bezeichnet hier ein Molekül mit einer oder mehreren Verzweigungen der Hauptkette.
Es handelt sich um eine Konstitutionsisomerie. Für sie wird auch der Begriff "Skelettisomerie" benutzt, da nur der Aufbau der eigentlichen Kohlenwasserstoffkette von Isomer zu Isomer verschieden ist. Während Butan nur die zwei oben dargestellten isomeren Formen besitzt, sind für das Hexan schon fünf mögliche Konstitutionsisomere zu finden.
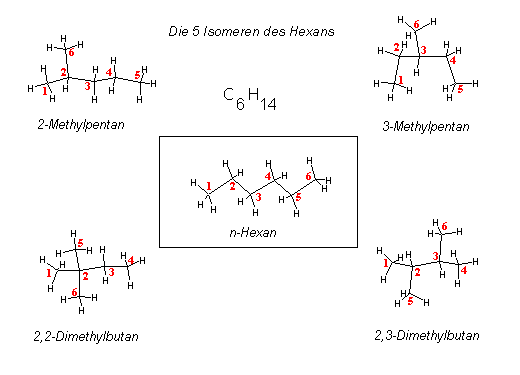
Benennung der Moleküle
Benannt werden die Verbindungen nach ihrer längsten Kette. Die Stellung der Seitenketten wird durch
eine Zahl angegeben, wobei an dem Ende der Hauptkette zu zählen begonnen wird, das der ersten Verzweigung
am nächsten ist. Die Zahl vor der Benennung der Seitenkette beschreibt, an welchem C-Atom der Hauptkette
die Seitenkette abzweigt. Kommt eine Seitenkette mehrmals im Molekül vor, muss man erst durchzählen, wie oft
dieses geschieht. Die Häufigkeit der Seitenkette wird dann zusätzlich durch griechische Vorsilben wie Di-
(zwei), Tri- (drei), Tetra- (vier) usw. angegeben. In folgendem Beispiel findet man diese Regeln
alle wieder.
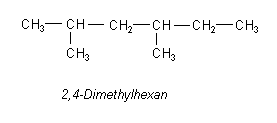
Mit wachsender Anzahl der Kohlenstoffatome im Molekül nimmt auch die Zahl der möglichen Isomere schnell zu.
Folgende Tabelle zeigt, wie viele Konstitutionsisomere bei bestimmter Anzahl von Kohlenstoffatomen im
Molekül rechnerisch existieren:
| Zahl der Kohlenstoffatome | Anzahl der möglichen Isomere |
| C1 | 1 |
| C2 | 1 |
| C3 | 1 |
| C4 | 2 |
| C5 | 3 |
| C6 | 5 |
| C7 | 9 |
| C8 | 18 |
| C9 | 35 |
| C10 | 75 |
| C11 | 159 |
| C12 | 355 |
| C13 | 802 |
| C14 | 1 858 |
| C15 | 4 347 |
| C16 | 10 359 |
| C17 | 24 894 |
| C18 | 60 523 |
| C19 | 147 284 |
| C20 | 366 319 |
| C25 | 36 797 588 |
| C30 | 4 111 846 763 |
| C40 | 62 491 178 805 831 |
An dieser Stelle noch eine kleine Bitte an die Lehrer: Es gibt nichts Langweiligeres, als endlos
exerzierte Nomenklaturregeln. Einige einfache Beispiele genügen zum Verständnis der Grundlagen. Auch in
Klassenarbeiten und Klausuren scheint es wenig sinnvoll, nur Benennungen von Kohlenwasserstoff-Molekülen
abzufragen.
Weitere Texte zum Thema „Kohlenwasserstoffe“