

Konformation der Alkane und freie Drehbarkeit ihrer Bindungen
Spielt man mit dem Molekülmodell der "Zick-Zack-Kohlenstoffkette" eines Alkanmoleküls, fällt auf, dass das gesamte Molekül jeweils in den Kohlenstoff-Kohlenstoff-Bindungsachsen drehbar ist. Dabei hakt es aber ab und zu.


Bild 1: Molekülmodelle von n-Octan.
Links: "Ordentliche" Kette, rechts: Kette "im Naturzustand"
(Fotos: Daggi)
Für diese Art von räumlichen Anordnungen eines Moleküls haben die Chemiker den Begriff der Konformation (lat. conformis = übereinstimmend) eingeführt. Die einzelnen Strukturen bezeichnet man als Konformationsisomere oder kurz "Konformere".
Zur Darstellung von Konformationsisomeren findet man in der chemischen Literatur verschiedene
Formen, wobei sich die "Sägebock-Darstellung" und die "Newman-Projektion"
durchgesetzt haben.
Da es aber nun natürlich unmöglich ist, alle Konformationsisomere, für jeden kleinsten Drehwinkel
um die Bindungsachse der Kohlenwasserstoffkette zu benennen, werden nur die jeweiligen extremen
Konformationsisomere betrachtet.
Die folgenden Abbildungen zeigen die entsprechenden Konformationen des Ethanmoleküls.
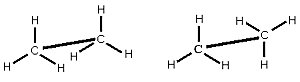 |
| Ethan in der Sägebock-Darstellung |
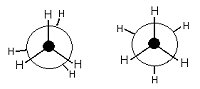 |
| Ethan in der Newman-Projektion |
Auf der jeweils linken Seite der beiden Darstellungsmöglichkeiten stehen die Bindungen zu den
Wasserstoffatomen direkt hintereinander. Diese Anordnung wird deshalb auch "verdeckte
Konformation" genannt.
Bei der "gestaffelten Konformation" (rechte Seite) stehen die Bindungen im größtmöglichen Abstand zueinander.
Die gestaffelte Konformation ist von beiden Möglichkeiten die energetisch günstigste, da die Wasserstoffe nicht in Wechselwirkung treten und den größtmöglichen Abstand voneinander besitzen. Dazwischen gibt es alle möglichen Übergänge mit unterschiedlicher potentieller Energie. Das zeigt das folgende Energiediagramm.
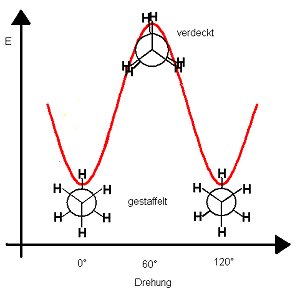
Man sollte mit einem Molekülbaukasten ein Kugelstab-Modell des Ethans nachbauen. Noch besser ist ein Kalottenmodell geeignet, um die unterschiedlichen potentiellen Energien der Konformere zu verdeutlichen.

Bild 2: Kalottenmodelle der Konformere des Ethans:
Links gestaffelt, rechts verdeckt
(Foto: Daggi)
Nun verstehen wir auch, dass der bei Schülern so beliebte "Alkoholhund"
gar nicht wie ein knuffiger Hund aussieht, der stolz den Schwanz nach oben trägt. Er sieht in der Realität eher
aus wie ein Hund, der am Baum sein Wässerchen macht... In die Überlegungen sollte man auch noch die C-OH-Bindung
einbeziehen. Wenn der Hund rückwärts schaut, stößt er im schlechtesten Fall mit der Schnauze an den Schwanz...

Bild 3: Kalottenmodelle der Konformere des Ethanols:
Links als Alkohol-Hund, in der Mitte gestaffelt, rechts verdeckt
(Foto: Daggi)
Weitere Texte zum Thema „Kohlenwasserstoffe“