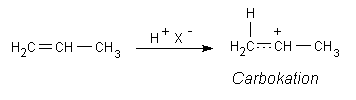
Die Addition von Säuren und von Wasser an Alkene
Das Proton einer starken Säure der Formel H-X kann elektrophil (elektronensuchend) an der schwachen und polarisierbaren π-Bindung der Alkene angreifen. Dabei denken wir daran, dass das H-X-Molekül polarisiert oder zumindest polarisierbar sein muss.
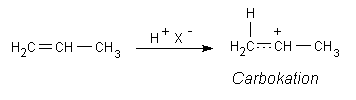
Durch die Protonenaddition entsteht ein Übergangszustand mit einem Mangel an Elektronen, das Carbokation.
An dieses Carbokation kann wiederum das nucleophile (kernsuchende) X--Teilchen mit seinem überzähligen Elektron addieren.
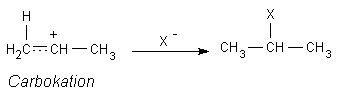
Das Endprodukt der Addition ist also ein einfach halogenierter und gesättigter Kohlenwasserstoff mit sp3-hybridisierten C-Atomen.
Wer viel hat, dem wird gegeben werden: Die Markownikoff-Regel
Bei einem unsymmetrischen Alken mit unterschiedlichen Resten an den beiden Seiten der Doppelbindung
sind die Positionen, an denen das Proton und das Anion X-) binden, nicht zufällig verteilt.
Bei der Addition von HCl an Propen wird nur das Chlorpropan gebildet, das das Chloratom am C-Atom 2 gebunden trägt (I).
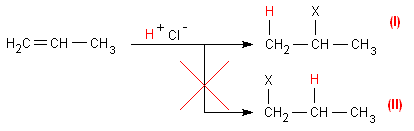
Diese Tatsache, die für ionisch ablaufende Additionen an die Doppelbindung gilt (das Carbokation als Zwischenstufe ist ein Ion), wird in der Markownikoff-Regel beschrieben.
Das Proton addiert als Elektrophil an das am wenigsten substituierte C-Atom, also an das,
welches den kürzeren Rest oder bereits mehr Wasserstoffatome an sich gebunden trägt.
Das Cl - als Nucleophil hingegen addiert an das höher substituierte C-Atom der Doppelbindung,
welches die größeren Reste und weniger gebundenen Wasserstoff trägt.
Auf diese Weise entstehen Moleküle optimaler Symmetrie. Diese haben vergleichsweise die geringste potentielle Energie. Das liegt letztlich daran, dass sich als Zwischenzustand ein möglichst symmetrisch gebautes Carbokation ausbildet.
Die Addition von Wasser
Auch die Addition von Wasser verläuft als elektrophile Addition entsprechend der Regel
von Markownikoff. Produkt ist ein Alkohol.
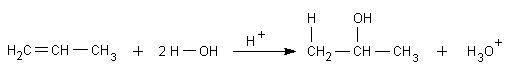
Diese Additionsreaktion wird durch starke Mineralsäuren, meist Schwefelsäure, katalysiert. Genau genommen
sind es die Protonen, die katalytisch wirken. Denn durch sie wird auch hier das Carbokation als Übergangszustand
gebildet.
Danach kann das stark polare Wassermolekül über seine freien Elektronenpaare als Nucleophil angreifen.
Das überzählige Proton wird nach dem Andocken des Wassermoleküls an ein weiteres Wassermolekül abgegeben. Es
befinden sich letztlich ebenso viele H+-Ionen in der Lösung wie zu Anfang der Reaktion.
Die Wirkung der Schwefelsäure ist also tatsächlich rein katalytisch.
Die Addition von Wasser an die Doppelbindung ist eine Gleichgewichtsreaktion. Bei der Rückreaktion wird Wasser abgespalten (Dehydratisierung).
Durch Änderung der Reaktionstemperatur und der Säurekonzentration kann die Reaktion gelenkt in die jeweilige Richtung ablaufen.

Die Rückreaktion ist das Gegenteil der Addition, eine Eliminierung. Durch sie lassen sich Alkene aus Halogenalkanen oder Alkoholen herstellen.
So beruht eine wichtige Darstellung von Ethen auf der Reaktion zwischen Ethanol und Schwefelsäure.
Weitere Texte zum Thema „Kohlenwasserstoffe“