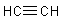
Die sp-Hybridisierung und Dreifachbindung
In den Molekülen der Alkine liegt eine Dreifachbindung zwischen den Kohlenstoffatomen vor.

Kalottenmodell von Ethin
(Foto: Daggi)
Die so miteinander verbundenen beiden Kohlenstoffatome besitzen zusammen 6 gemeinsame Bindungselektronen.
Auch bei den Alkinen findet eine Hybridisierung zwischen s- und p-Orbitalen statt. Doch hierbei vermischt sich nur noch ein 2s-Orbital mit dem 2p-Orbital, wodurch zwei neue Orbitale entstehen, die zu einer Hälfte s- und zur anderen Hälfte p-Charakter besitzen. Diese Hybridorbitale heißen sp-Orbitale (genau genommen s1p1-Orbitale).
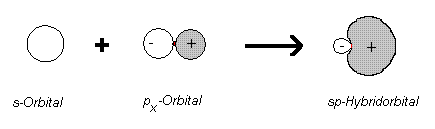
Es entstehen hierbei pro C-Atom zwei identische Hybridorbitale, die energetisch betrachtet zwischen den s- und p-Orbitalen liegen.
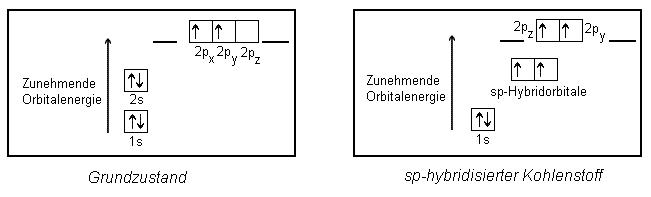
Wie man sieht, gehen zwei hantelförmige p-Orbitale (py und pz) nicht in die Hybridisierung ein. Sie bleiben "unangetastet" in einem Winkel von 90° zueinander erhalten.
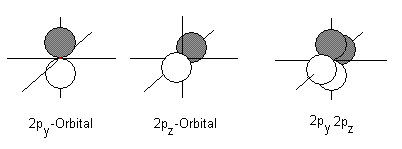
Vergleicht man die Größe des sp-Hybridorbitals mit der des sp2- und des sp3-Hybridorbitals der Alkene bzw. Alkane, so fällt auf, dass diese durch den geringeren p-Anteil kürzer und gedrungener erscheinen. Das gilt auch schon für den Unterschied zwischen den sp2- und sp3-Orbitalen.
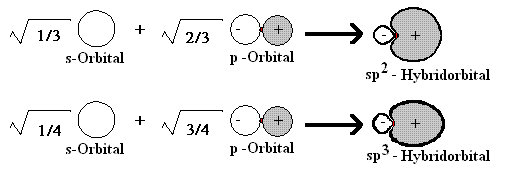
Die Bindungslänge zwischen den sp-hybridisierten Kohlenstoffatomen untereinander und auch zum Wasserstoff als Bindungspartner ist also geringer. Dieses wiederum hat kürzere Bindungslängen als das Ethan.
Wie sieht ein Alkin-Molekül aus?
Als Beispiel betrachten wir wieder einen C2-Körper, und zwar das Ethin (Acetylen, C2H2).
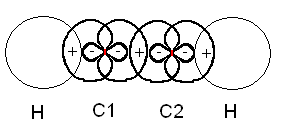
Die beiden identischen sp-Hybridorbitale stehen in einem Winkel von 180° zueinander und bilden durch Überlappung die
σ-Bindung zwischen den beiden C-Atomen. Auch die beiden Wasserstoffatome sind über σ-Bindungen an sie
gebunden. Schließlich verfügt ja jedes C-Atom über zwei sp-Orbitale.
Die beiden py- und die beiden pz-Orbitale formen zwei π-Bindungen, die senkrecht aufeinander stehen. Sie scheinen förmlich die σ-Bindungsachse zu umgeben.
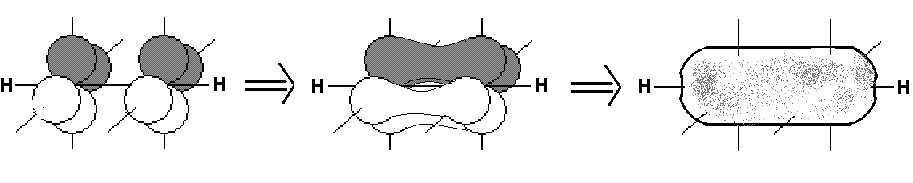
Da auch die beiden π-Elektronenpaare absolut gleichwertig sind, verschmelzen die p-Orbitale gänzlich miteinander und umgeben die σ-Bindungsachse als zylindrischen, gemeinsamen Aufenthaltsraum wie eine zweite Haut.
(Die Hybridorbitale der σ-Bindung sind in dieser Darstellung übrigens aus Gründen der Übersichtlichkeit nur durch die Linie der Bindungsachse dargestellt.)
Wegen dieser Verschmelzung erweist sich die Dreifachbindung der Alkine als unerwartet stark. So verläuft die Bromierung von Ethin - anders als beim Ethen - nur sehr langsam.
Die Verringerung des Kernabstands führt auch dazu, dass die C-Atome die H-Atome abstoßen. Folglich verhält sich Ethin wie eine Säure und bildet sogar Salze, die Carbide.
Weitere Texte zum Thema „Kohlenwasserstoffe“