Wechselwirkung zwischen Adsorptionsmitteln und adsorbierten Substanzen
Experimente:
Versuch: Adsorption von Dichlormethandämpfen
Versuch: Vergleichende Adsorption von Farbstoffen an Aluminiumoxid und Kieselgel
Bei den Adsorptionsmitteln unterscheidet man polare von unpolaren Phasen.
| - | Polare Adsorptionsmittel:
Eisenoxid, Kieselgel, Aluminiumoxid, Kreide, Kohlenhydrate (Cellulose) |
| - | Unpolare Adsorptionsmittel:
Aktivkohle, Kunststoffe (z. B. PU) |
Bei der Adsorption einer Substanz gilt das bekannte Prinzip "Gleiches löst sich in Gleichem": Polare Adsorptionsmittel adsorbieren stärker diejenigen Substanzen, die polar sind. Hingegen adsorbieren unpolare Adsorptionsmittel wiederum unpolare Substanzen (-> Versuch).
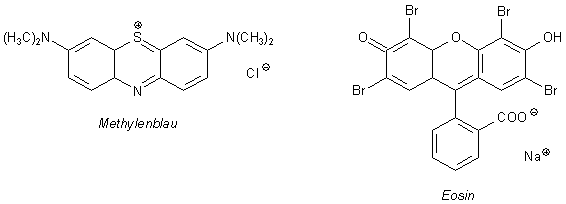
Aber auch innerhalb der beiden Gruppen von Adsorptionsmitteln lassen sich Unterschiede erkennen. Das lässt sich anhand der Trennung von Gemischen von Farbstoffen wie Eosin und Methylenblau demonstrieren (-> Versuch). Diese beiden unterscheiden sich in ihrer Ladung:

Behandelt man die Mischlösung einmal mit Kieselgel und das andere Mal mit Aluminiumoxid, so erhält man unterschiedliche Auftrennungen. Dies zeigt das folgende Bild des Ergebnisses eines entsprechenden Reagenzglasversuchs.

Von Links: Reine Eosin-Lösung
Eosin-Methylenblau-Lösung mit Bodensatz von Kieselgel
Eosin-Methylenblau-Lösung mit Aluminiumoxid
Reine Methylenblau-Lösung
(Foto: Steffi)
Aluminiumoxid
Aluminiumoxid hat wegen seines stark polaren Aufbaus, an dem Al3+-Ionen
beteiligt sind, die Eigenschaften eines Anionenaustauschers. Das negativ geladene Eosin-Molekül
bleibt deshalb am Aluminiumoxid "hängen".
Das Methylenblau dagegen verbleibt im Lösemittel. Seine Moleküle sind positiv geladen
und werden von den ebenfalls positiven Al3+-Ionen nicht gebunden, da gleiche Ladungen
sich abstoßen.
Kieselgel
Anders ist das mit dem polaren Adsorptionsmittel Kieselgel. Kieselgel liegt in
polymerer Form vor. Wässrige Kieselgel-Suspensionen (SiO2 ·
x H2O) enthalten als polymere Kieselsäure anionenartige, negative
Ladungen. Das positiv geladene Methylenblau-Molekül wird deshalb vom Kieselgel adsorbiert.
Kieselgel wirkt somit als Kationenaustauscher.
Gleiche Ladungen stoßen sich ab. So bleibt das negativ geladene Eosin in Lösung.
Wir sehen, dass beide Adsorbentien neben Adsorptions-Eigenschaften offensichtlich auch Ionenaustauscher-Eigenschaften aufweisen. Genau genommen spielen bei der Fixierung der Molekül-Ionen der Farbstoffe aber auch van der Waals-Kräfte sowie Wasserstoffbrückenbindungen eine Rolle.
Dies ist wieder einmal ein Beispiel dafür, dass man in der Chromatographie nur selten einen beobachteten Effekt durch eine einzige Ursache beschreiben kann.
Ein Beispiel aus der organischen Chemie
Betrachten wir einmal eine homologe Reihe wie die der n-Alkohole:
Methanol - Ethanol - Propanol - Butanol - Pentanol
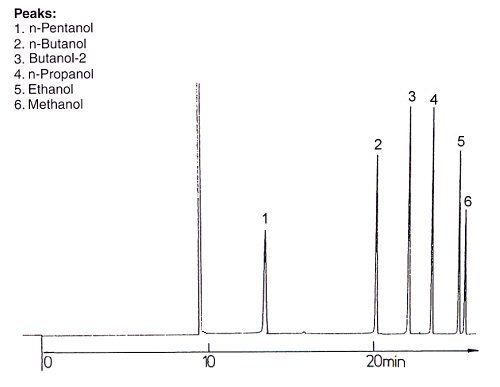
Auf einer polaren Säule wirkt sich besonders die hydrophile OH-Gruppe aus. Hier wird in erster Linie Methanol adsorbiert, während Pentanol nicht so stark fixiert wird. Deshalb verlässt Pentanol als erster Alkohol die Säule, während Methanol zuletzt erscheint. Die anderen Alkohole liegen dazwischen.
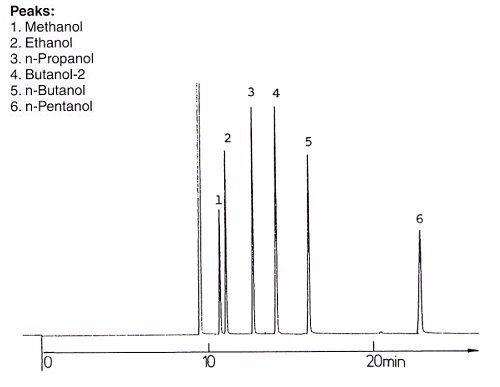
Auf einer unpolaren Säule ist es genau umgekehrt. Hier wirkt sich der lipophile aliphatische Rest als Ursache der Fixierung aus. Folglich erscheint zuerst Methanol im Auslauf und Pentanol erst zum Schluss.
Wir erhalten deshalb folgende Gas-Chromatogramme:
1. Polare Säule
2. Unpolare Säule
Man kann heute die Oberflächen einer stationären Phase ganz gezielt verändern. So wird zum Beispiel die Polarität von Kieselgel durch Veresterung mit mehr oder weniger langkettigen Alkoholen gesenkt. Das geht soweit, dass man sogar die Phaseneigenschaften des Kieselgels von ursprünglich polar nach unpolar umdrehen kann. Man spricht hier von Reversed Phase-Säulen. Auf diese Weise sind alle denkbaren Abstufungen in der Polarität und damit in der Selektivität möglich, so dass heute für jedes Trennungsproblem eine maßgeschneiderte stationäre Phase zur Verfügung gestellt werden kann.
Weitere Texte zum Thema „Chromatographie“