Molekularsiebe - eine eher zufällige Entdeckung
Die Bergbau-Forschung untersuchte Mitte der 60er Jahre das Phänomen der Selbstentzündung von Kohlehalden. Denn Kohle und Sauerstoff bilden ein metastabiles Gemisch, das auf eine entsprechende Aktivierung wartet. Und so kam es immer wieder zu Bränden auf Halden und in Flözen. Das ist auch heute noch ein Riesenproblem - zum Beispiel in China.
Im Experiment füllte man Kohlepulver in ein Rohr. Durch dieses wurde ein
Luftstrom geleitet. Am Röhrenausgang wurde kontinuierlich die Sauerstoffkonzentration
gemessen, um eine mögliche Reaktion zwischen Kohle und Sauerstoff verfolgen zu
können. Dabei trat ein zunächst unerklärliches Phänomen auf: Kurz nach dem
Beginn des Durchströmens der Luft stellte sich am Röhrenausgang eine
vorübergehende starke Verringerung der Sauerstoffkonzentration ein, die sich
jedoch nach einigen Minuten wieder der Konzentration in der zugeführten Luft anglich.
Zwar half dieses Phänomen nicht weiter, das Problem der Selbstentzündung von
Kohlehalden und -flözen zu klären. Man hätte ja denken können, dass der Sauerstoff
mit der Kohle reagiert. Aber nichts wies darauf hin. Es war anders: Die Kohle
adsorbierte ganz einfach den Sauerstoff und ließ den Stickstoff passieren!
Eine ganze Weile musste vergehen, bis den Forschern klar wurde, dass dieses Phänomen vielleicht auch anders genutzt werden könnte. Des Rätsels Lösung sind die Größenunterschiede zwischen Molekülen wie O2 oder N2. Eine Abnahme des Sauerstoffanteils der Luft beim Durchströmen der Kohle könnte ja genutzt werden, um Sauerstoff und Stickstoff zu trennen. Die Kohle wirkte somit wie ein Sieb für Moleküle - sie ist ein Molekularsieb.
Wie wir gleich sehen werden, ist der Begriff "Sieb" jedoch irreführend. Denn anders als ein Küchensieb hält ein Molekularsieb die kleinen Moleküle zurück und lässt die großen passieren.
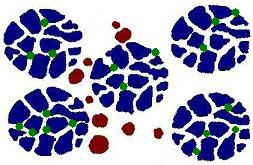
Ein Molekularsieb besitzt ein Gerüst, das von Kanälen (Poren) durchzogen ist.
Dieses kommt in Kontakt mit einem Gas, das aus zwei Stoffen wie zum Beispiel O2 und N2 besteht. Die O2-Moleküle sind kleiner als die von N2. Die Moleküle von Stickstoff sind größer als die Poren des Molekularsiebes. Diese Moleküle werden nicht in die Poren des Molekularsiebes eindringen können, sondern "außen" herum wandern. Die Moleküle des Sauerstoffs sind kleiner, gelangen in die Poren des Molekularsiebes und können sogar adsorbiert werden. Letztere wandern also verzögert durch die Füllung der Säule, während die größeren Moleküle der Mischung direkt und somit schneller das Rohr passieren.
Mittlerweile hat man viele andere Substanzen gefunden, die sich als Molekularsiebe nutzen lassen und aus denen man sogar Membranen herstellen kann. Heute trennt man damit die Luft in ihre Bestandteile, ohne die Luft zuvor aufwendig nach dem Lindeverfahren verflüssigen zu müssen.

Kleine Moleküle (grün) können in den Poren des Molekularsiebs (blau)
eindringen und wandern daher langsamer als die größeren (braun)
(Foto: Steffi)
Das Molekularsieb nutzt man besonders auch in der Biochemie, um
Proteine zu reinigen und deren Lösungen dabei vor allem von kleineren Peptiden,
Aminosäuren oder Salzen zu befreien.
Selbst Bier wird auf diese Weise vom Alkohol befreit. Wichtig für Alkoholsucht-Gefährdete ist Folgendes: "Befreit" ist nicht ganz richtig, denn ein Rest um 0,5 % bleibt immer in der Lösung. Schließlich handelt es sich hier um Austauschvorgänge, die exponentiellen oder hyperbolischen Gesetzen folgen und somit asymptotisch verlaufen! Lies hierzu alles zum Adsorptionsgleichgewicht.
Besonders gern genutzt werden polymere Kohlenhydrate wie Sephadex, aber auch das schon bekannte Kieselgel. Wichtig sind auch die Zeolithe, die man maßgeschneidert synthetisieren kann. Man stellt auch entsprechend genau zusammengesetzte Kunststoffgele her und kombiniert diese Trennungsmethode mit der Elektrophorese (Gel-Elektrophorese). Bei diesen Gelen kann man durch Variation des Vernetzungsgrades sogar einen Porengröße-Gradienten aufsetzen (Disk-Elektrophorese).
Auch zur Entwässerung von Lösemitteln werden Molekularsiebe genutzt. Dazu füllt man eine Portion von den festen Siebkügelchen in die Flasche und hat immer trockene Lösemittel zur Hand. Früher trocknete man Lösemittel durch Einpressen von Natriummetall oder durch Destillation mit Wasser-Schleppsubstanzen. Besonders beim Trocknen von Acetonitril hat sich diese Methode bewährt. Dabei handelt es sich um ein wichtiges Lösemittel für die HPLC.
Weitere Texte zum Thema „Chromatographie“