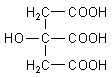
Das Kalottenmodell der Citronensäure
Kalottenmodelle zeigen die wahren Bindungsverhältnisse besser als Strichformeln. Trotzdem orientiert man sich beim Bau des Kalottenmodells zunächst an der Fischerprojektion.
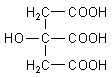
Man fängt an, indem man die richtigen Kalottenteile zusammensucht und daraus zumindest einmal die Reihe der zugrunde liegenden Kohlenstoffkette baut. Dann werden die Substituenten angesetzt. Hier ist das nicht weiter schwierig, weil das Molekül der Citronensäure kein asymmetrisches C-Atom aufweist - wie etwa die Moleküle der Zucker. Wenn man das Modell der Citronensäure endlich fertig gebaut hat, steht man allerdings zunächst vor einem ziemlich ungeordneten Haufen von Atomen, die ein Molekül formen. Wo ist da die bekannte Struktursymmetrie?
Drehen Sie einfach die drei Carboxylgruppen so auf eine Seite, dass diese ein Ca-Ion binden könnten. Dann haben Sie quasi den halben Ca-citrat-Komplex hergestellt.
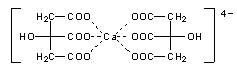
Diese Kalotten zeigen wir in den folgenden Bildern.


Zwei Ansichten des Kalottenmodells der Citronensäure.
Die Ziffern bezeichnen die H-Atome der drei Carboxylgruppen
(Fotos: Blume)
Nun erkennen Sie auch die Symmetrie, für die das Molekül der Citronensäure berühmt ist.
Weitere Texte zum Thema „Zitrone“