Versuch: Wie ein Nickel-Cadmium-Akku aufgebaut ist
Demonstrationsversuch; 20 min.
Beim Experimentieren den Allgemeinen Warnhinweis unbedingt beachten.
Geräte
Metallsäge, Schraubstock, Pinzette, Voltmeter, Ladegerät.
Chemikalien/Material
Indikatorpapier, Kalilauge (c = 1 mol/l) (C).
Durchführung
Beim Öffnen unbedingt Handschuhe und Schutzbrille tragen! Der Inhalt ist
ätzend und giftig.
1 Öffnen
Man entfernt zunächst die Kunststoffummantelung der Zelle, spannt den Akku in einen
Schraubstock und sägt dann den Boden ab. Anschließend sägt oder feilt man den
Metallmantel senkrecht dazu an, biegt ihn auf und entrollt vorsichtig die im Element
enthaltenen Wickelelektroden (Bild 1).

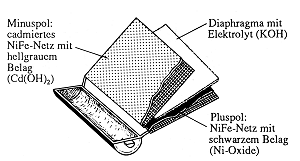
Bild 1: Aufgesägter Ni/Cd-Akku
(Quelle: Cornelsen)
Man findet zwei Metallnetze oder Metallsiebe mit unterschiedlich gefärbten Belägen
und folgender Zusammensetzung. Der beschriebene Zustand ist der eines geladenen
Akkus.
Minuspol:
Netz aus Eisen mit Cadmiumüberzug und hellgrauem Belag von Cadmiumhydroxid.
Pluspol:
Netz aus Nickel mit schwarzem Belag von Nickel(IV)-oxid.
Dazwischen liegt ein feuchtes, filzartiges Gewebe, das die Elektrodenräume trennt
und zugleich den Elektrolyten, konzentrierte Kalilauge, enthält. Dies wird mit
Indikatorpapier geprüft.
Die Aufwicklung und netzartige Gestaltung der Elektroden vergrößern deren
Oberfläche und sorgen für bessere Haftung der Beläge. Damit wird die Stromausbeute
entsprechend erhöht.
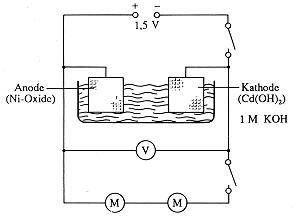
Bild 2: Schaltbild zum Aufladen der Akkubestandteile
(Quelle: Cornelsen)
2 Demonstration der Funktionsweise
Dazu trennt man die beiden Wickelelektroden heraus, wobei man darauf achtet, dass
nicht zuviel vom Belag abblättert. Dann hängt man sie in Kalilauge (c = 1 mol/l) (C).
Man schließt das helle Netz an den Minuspol, das schwarze an den Pluspol eines
Netzgeräts an und elektrolysiert bei 1,8-2 V (Bild 2). Der Akku sollte nur kurz
aufgeladen werden, da sonst der Entladevorgang zu lange dauert.
Nach kurzem Aufladen misst man die Spannung. Sie liegt bei 1,3 V. Man schaltet einen
Motor in den Stromkreis. Man beobachtet dabei nur einen Spannungsabfall auf 1,25
V.
Entsorgung
Die Reste gehören in die Gefäße mit Schwermetallabfällen.