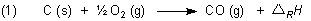
Von den Reaktionsenthalpien „unmöglicher Reaktionen“.
Der Heßsche Satz
Experimente:
Versuch: Brennbarkeit von CO
Versuch: Oszillationen bei der Oxidation von Methanol mit Platinnetz
Oft gibt es Prozesse, bei denen zur Berechnung von Energien, Umsätzen und andere Daten schlicht einige
Energiewerte fehlen. Beispielsweise kann man die Enthalpie zur Bildung von CO durch Verbrennung von C nicht direkt
bestimmen, da die Reaktion stets zum allergrößten Teil zu CO2 führt.
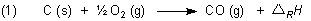
Es gibt aber einen mathematischen Trick, der auf Grundsätzen der Thermodynamik beruht. Diese Wissenschaft befasst sich mit der Beschreibung der stabilen Zustände der Systeme und deren Änderungen, wobei es sich als unwichtig heraus stellt, auf welchem Weg die Zustände erreicht werden. So werden die Energieabstände zwischen den Zuständen stets nur durch die Daten der Zustandseigenschaften beschrieben.
Anders gesagt: Der Übergang von einem Zustand in den anderen ist unabhängig vom Weg. Das heißt, dass ausgehend vom stabilen Anfangszustand [C + x O2] der Endzustand [CO2] auch über den Zwischenzustand [CO] erreicht werden kann. Auf diese Weise kann man Energien berechnen, die praktisch nicht zugänglich sind.
Voraussetzung ist das Prinzip der Summation der Energien.
Beispiel CO-Bildung
Wenn man Kohlenstoff verbrennt, entsteht kaum CO. Wie soll man da die Verbrennungsenthalpie
bzw. die Bildungsenthalpie von CO ermitteln? Diese Werte zu kennen ist für die Technik
wichtig, z. B. beim Arbeiten mit Stadt- oder Leuchtgas muss man den Wert kennen.
Zur Erinnerung: Stadtgas besteht zu ca. 5 % aus CO.
Über Umwege kann man zu den gewünschten Energiewerten gelangen. Dazu muss man nur CO zu CO2 sowie C zu CO2 verbrennen. Die Reaktionsenthalpien sind deshalb in diesem Fall Verbrennungsenthalpien (Symbol Δc H). Lassen wir die Reaktionen unter Standardbedingungen ablaufen, so erhalten wir die Standardverbrennungsenthalpien (Symbol ΔR H 0), mit denen wir hier weiter arbeiten wollen.
Hier sind zunächst die Reaktionsgleichungen
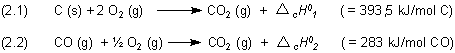
Subtrahieren wir die beiden Gleichungen (2.1) und (2.2), so folgt entsprechend den Regeln der Algebra
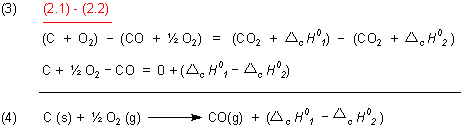
Gehen wir zurück zu den Reaktionsgleichungen (2.1) und (2.2). Die Standardverbrennungsenthalpien setzen sich zusammen aus den Standardbildungsenergien der an der Reaktion beteiligten Stoffe. Allgemein gilt:
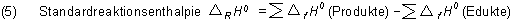
Angewendet auf Gleichungen (2.1) und (2.2):
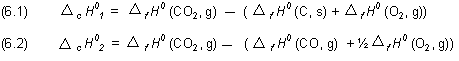
Mit dem Satz, dass die Standardbildungsenthalpien der Elemente gleich Null sind, folgt für die Enthalpieänderung:
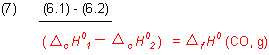
Die Enthalpieänderung ist also gleich der Standardbildungsenthalpie von CO.
Daraus folgt für die Reaktionsgleichung (4):
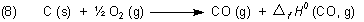
Wir setzen die Werte der Verbrennungsenthalpien aus Gl. (2.1) und (2.2) in Gl. (7) ein und berücksichtigen dabei, dass die Standardbildungsenthalpie ein negatives Vorzeichen trägt.
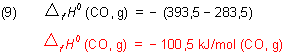
Wir können festhalten: Da die Verbindung CO aus ihren Elementen C und O2 gebildet wird, ist die Verbrennungsenthalpie von C nach CO dem Wert nach gleich der Bildungsenthalpie von CO - nur mit entgegen gesetztem Vorzeichen versehen.
Man kann das Prinzip des Heßschen Satzes auch graphisch herleiten
Auch hierbei muss man auf die Vorzeichen der Enthalpien achten!
Weitere Beispiele für die Anwendung des Heßschen Satzes
Wie man die Standardbildungsenthalpie von Methan ermittelt, zeigen wir auf einer besonderen
Webseite. Dazu benötigt man nur die Verbrennungsenthalpien von Methan sowie die seiner Elemente C und Wasserstoff.
Ein anderes, nicht ohne Weiteres experimentelles Beispiel ist die Bildung von Methanol aus Methan. Entzündet man nämlich Methan, so reagiert es ab bis zu CO2 und H2O. Wie soll man da zum Beispiel die Reaktionsenthalpie der folgenden Reaktion ermitteln?
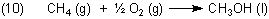
Ähnliche Probleme bietet die Bildung von Formaldehyd aus Methanol.
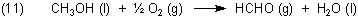
Hier findet man die zur Berechnung notwenigen Daten.
Solche Überlegungen und Rechnungen sind zum Beispiel wichtig für das Verständnis enzymatischer Reaktionen oder von Katalysereaktionen allgemein.
Weitere Texte zum Thema „Energie und Chemie“