
Physikalische Eigenschaften der Essigsäure
Experimente:
Versuch: Kristallisation von Essigsäure
Chemisch reine Essigsäure ist eine wasserhelle, farblose, stechend riechende Flüssigkeit.
Ihr Siedepunkt liegt bei 118 °C. Ihr Schmelzpunkt wird in der Literatur mit 16,5 °C angegeben.
Wer erwartet, dass reine Essigsäure ab 16,5 °C fest wird und "gefrorene" Essigsäure deshalb in
jedem kühlen Labor zu besichtigen sein sollte, wird enttäuscht (-> Versuch);
Essigsäure wird erst bei etwa 0 °C fest. Grund: Die Essigsäure neigt stark zur Kristallisationshemmung
und bildet deshalb leicht unterkühlte Flüssigkeiten. (Warum das so ist, erklären wir weiter unten.)
Wenn die Kristallisation einmal begonnen hat, steigt die Temperatur aufgrund der freigesetzten latenten
Kristallisationswärme an (siehe Bild), bis sie den Gleichgewichtswert von 16,5 °C erreicht hat.
Beim Gefrieren bildet sich eine eisartige Masse. Deshalb nennt man reine Essigsäure auch Eisessig. Dieser taut erst bei 16,5 °C wieder auf.

Eisessig (Foto: Daggi)
Mit Wasser, Alkohol, Ether, Tetrachlorkohlenstoff, Chloroform und Glycerin ist Essigsäure in
jedem Verhältnis mischbar. Das ist erstaunlich, haben die genannten Lösemittel doch höchst
unterschiedliche Polaritäten!
Man könnte meinen, dass das daran liegt, dass auch die Moleküle der Essigsäure eine ausgewogene
Polarität zeigen: Die CH3-Gruppe ist unpolar, die COOH-Gruppe dagegen ist polar. Der
wirkliche Grund ist jedoch, dass Essigsäure in unpolaren Lösemitteln ihre polare Seite versteckt,
indem sie Dimere bildet.
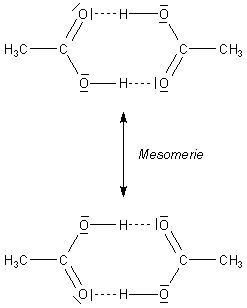
Wir erkennen, dass die Dimere durch Wasserstoffbrücken zusammengehalten werden. Für die bemerkenswerte Stabilität dieser Dimere sorgt noch ein anderer Effekt: Es kommt zu einem Bindungsausgleich zwischen den beiden gezeichneten Strukturen. Das hat zur Folge, dass bei der Dimerisierung Energie frei wird. Es sind pro Mol etwa 60 kJ. Wir sprechen bei dieser Art der Stabilisierung von "Mesomerie".
Auch in Kristallen liegen solche Dimere vor. Sie bauen das Kristallgitter auf. Die Dimerenbildung ist somit Voraussetzung für die Kristallbildung. Sie ist auch der Grund für die notwendige Unterkühlung von Essigsäure. Denn die "Kopf an Kopf-Bindungen" haben eine exakte sterische Ausrichtung jeweils zweier Moleküle zur Voraussetzung, was eine Einschränkung ihrer Bewegung erfordert und durch zusätzliche Abkühlung gefördert wird.
Das Lösen der Wasserstoffbrückenbindungen dagegen erfordert viel Energie. Folglich liegt der Schmelzpunkt so hoch.
Weitere Texte zum Thema „Essig“