Der Einstieg
Brennstoffzellen - hoher Wirkungsgrad, aber wenig Energie
Energie sinnvoll nutzen kann man nicht nur durch Verringerung des Verbrauchs, sondern
auch z. B. durch Erhöhen des Wirkungsgrades. Hierzu dient die gezielte Steuerung der
energieliefernden chemischen Reaktion sowie die der dabei auftretenden
Energieumwandlungen. Ein Beispiel hierfür ist die Brennstoffzelle.
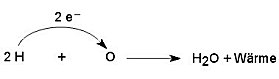
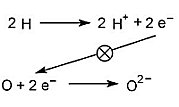
Eine Brennstoffzelle ist eine galvanische Zelle, bei der die chemische Energie, die üblicherweise bei Verbrennungen von nichtmetallischen Substanzen als minderwertige Energieform Wärme frei wird, direkt in hochwertige elektrische Energie umgewandelt wird. Man spricht hier treffend vom Kalten Feuer. Schwermetalle und ihre Verbindungen spielen hier keine Rolle, wenn man von dem katalytisch wirkenden Elektrodenmaterial absieht. Bei der Knallgasreaktion übertragen zwei Wasserstoffatome je ein Elektron direkt auf ein Sauerstoffatom.

Der Vorteil gegenüber normalen Batterien bzw. Akkumulatoren liegt auf der Hand: Wenn die
Energielieferung aufhört, muss nicht wie beim Zink-Brom-Element umständlich aufgeladen
werden, sondern nur Wasserstoff getankt werden. Auch die lästige Vorheizung wie bei dem
Natrium-Schwefel-Akkumulator entfällt. Außerdem beträgt bei gleichem
Energieinhalt die Masse der Brennstoffzelle nur ein Drittel der bislang üblichen
Akkumulatoren.
Hinzu kommt, dass die Brennstoffzelle schadstoffarm ist: Mit Wasserstoff als Brennstoff
entsteht als Reaktionsprodukt (anders als bei der Verbrennung von Wasserstoff, wobei z. B.
auch Stickoxide gebildet werden) wirklich nur Wasser.
Wasserstoff kann mit Hilfe der Elektrolyse durch Solarenergie gewonnen werden. Aber auch
durch thermisches Cracken von Erdgas ist er herstellbar. Man hat weiterhin Verfahren
entwickelt, Wasserstoff auch mit Hilfe von fotosynthetisierenden Bakterien zu entwickeln.
Der einzige Nachteil: Der apparative Aufwand für den Transport von Wasserstoff ist momentan noch sehr groß, vor allem wegen der Kühlvorrichtungen. In der Erprobung sind aber auch Hydridspeicher, die den Wasserstoff z. B. als Lithiumhydrid gebunden enthalten. Nach der Definition der Brennstoffzelle stellt sich die Frage, ob man ein solches Element nicht auch mit den klassischen Brennstoffen, also mit fossilen Brennstoffen oder mit Biomasse oder deren Produkten betreiben kann. Beispiele sind Kohlenwasserstoffe wie Erdgas, Butan oder Benzin, Biogas aus Kläranlagen, Alkohole oder Glucose. Das Problem bei diesen Brennstoffen ist allerdings, dass reine Platinbleche eine nur geringe Energieausbeute ermöglichen. Das stellt man auch im folgenden Versuch fest. Deshalb wird fieberhaft nach Elektrodenmaterial gesucht, das einen höheren Wirkungsgrad garantiert.
Bei der Verwendung von Methan als Brennstoff laufen folgende Redoxreaktionen ab:
Minuspol: CH4 + 2 H2O ———> CO2 +
8 H+ + 8 e-
Pluspol: 2 O2 + 4 H2O +
8 e- ———> 8 OH-
--------------------------------------------------------------------------
Gesamtreaktion: CH4 + 2 O2 ———> CO2 +
2 H2O
(Die Oxonium-Ionen H3O+ und Hydroxid-Ionen OH- reagieren zu Wasser.)
Die hier vorgestellten Versuchsmodelle können statt mit Wasserstoff auch mit Methan (Erdgas) betrieben werden. Die erreichbare Klemmenspannung ist allerdings geringer als bei Verwendung von Wasserstoff.
Aber auch Alkohole oder Glucose dienen als Brennstoffe für die Brennstoffzelle. Dies sind ebenfalls Rohstoffe, die sich aus Holz und aus anderer Biomasse herstellen lassen. Die Einzelreaktionen der verschiedenen Reaktionsräume können für Methanol als Brennstoff so formuliert werden:
Minuspol: CH3OH + H2O ———> CO2 +
6 H+ + 6 e-
Pluspol: O2 + 2 H2O + 4 e-
———> 4 OH-
---------------------------------------------------------------------------------
Gesamtreaktion: 2 CH3OH + 3 O2 ———>
2 CO2 + 4 H2O
Die mit organischen Brennstoffen betriebene Zelle produziert natürlich auch
Kohlenstoffdioxid. Ihre Abgase sind aber frei von den anderen typischen Schadstoffen wie
CO, NOx, SOx oder
Aldehyden, die bei der offenen Verbrennung anfallen. Hinzu kommt der
wesentlich höhere Wirkungsgrad, der noch durch spezielle Membrantechnologien gesteigert
werden kann. Zu den hier vorgestellten Brennstoffzellen können
Berechnungen des
Wirkungsgrades
angestellt werden.
Brennstoffzellen werden deshalb in der zukünftigen Technologie von schadstoffarmen
Energieumwandlungen an Bedeutung gewinnen. In Norwegen wird bereits eine Großanlage
gebaut, in die direkt Erdgas von den in der Nordsee gelegenen Erdölfeldern eingespeist wird.
Text und Bilder entnommen aus: [2]
Weitere Texte zum Thema „Brennstoffzellen“