|
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1016
F: Ich würde gerne wissen was es mit den intermolekularen
wasserstoff(brücken)bindungen bei der phthalsäure auf sich hat, sowie den nachbargruppeneffekten bei
der phthalsäure.
A: Betrachten wir die klassische o-Phthalsäure: Die beiden
nebeneinander stehenden COOH-Gruppen beeinflussen sich. Sie bilden Wasserstoffbrücken untereinander aus.
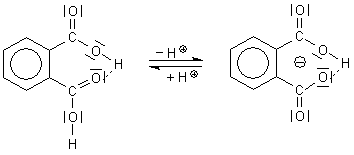
Damit lockern sie zunächst eine O-H-Bindung. Das Proton dissoziiert leichter ab als bei einer Monocorbonsäure
oder bei einer Dicarbonsäure ohne Wechselwirkung wie der m-Phthalsäure (Isophthalsäure) oder der p-Phthalsäure
(Terephthalsäure).
Danach tritt aber der gegenteilige Effekt ein, dass die nun entstehende H-Brücke stärker fixiert ist. Das
geschieht einmal durch die negative Ladung. Außerdem entsteht ein planarer und weitgehend spannungsfreier, völlig
symmetrischer Ring. Alle Kohlenstoffe und Sauerstoffe sind sp2-hybridisiert. Die Planarität ermöglicht
somit eine Mesomerie, die das System noch zusätzlich stabilisiert. Folge: Das zweite Proton dissoziiert bei
deutlich höherem pH-Wert als bei den "normalen" Dicarbonsäuren ab.
Das zeigt der Vergleich der pKa-Werte:
| o-Phthalsäure | pK1 = 2,90 | pK2 = 5,35 |
| m-Phthalsäure | pK1 = 3,52 | pK2 = 4,55 |
| p-Phthalsäure | pK1 = 3,51 | pK2 = 4,82 |
Ähnliches (wenn auch mit extremerer pKa-Wert-Differenz) wie bei der o-Phthalsäure beobachtet man auch bei der vinylogen Ascorbinsäure. Dazu haben wir eine Webseite.
1017
F: Ich habe eine sehr spezielle Frage an Sie.
Wir hatten in einer Chemieklausur (Stufe 13) die Aufgabe, einen Mechanismus zu entwerfen, wie man
Natriumacetat herstellen könnte. Als Vorgabe hatten wir, eine Reaktion von Essigsäure mit Natriumhydroxid.
Nun sollten wir uns eine eigene Reaktion ausdenken, mit der man das Acetat auch herstellen könnte. Einige,
ich auch, haben eine Reaktion von Essigsäure und Kochsalz (NaCl) angegeben. Dies wurde aber (noch) nicht
anerkannt, weil es nicht funktionieren sollte. Einer dieser Schüler hat in seiner Klausur angegeben, dass
man das Chlor aus der Lösung entfernen sollte, damit sich Natriumacetat bilden kann.
Nun frage ich Sie, ob die von mir genannte Reaktion (Essigsäure+Kochsalz) funktionieren könnte und wenn
ja wie. Und wie könnte man aus einer Lösung Chlor entfernen?
Wir sind bei unseren Diskussionen zu keinem Ergebnis gekommen. Ich hoffe Sie können uns weiterhelfen.
Wenn nicht ist es auch nicht schlimm. Wir haben nur den Ansporn endlich mal mehr zu wissen als unsere Lehrerin.
Außerdem hoffen wir so auf eine höhere Punktzahl in der Klausur.
A: Beim Eindunsten einer Essigsäure/NaCl-Mischung wird Ihnen immer zuerst
das schwerer lösliche NaCl auskristallisieren.
Die Elektrolyse einer Acetatlösung führt vor allem zur anodischen Bildung von Ethan.
2 CH3COO- ———> C2H6 + 2 CO2 + 2 e-
Die direkte Reaktion von Essigsäure mit Natrium ist nicht empfehlenswert.
Lassen Sie also Essigsäure mit Natriumhydrogencarbonat reagieren.
NaHCO3 + CH3COOH ———> CH3COONa + H2O + CO2
Die Essigsäure treibt die Kohlensäure aus. Natriumacetat bleibt in der Lösung zurück. Die lassen
Sie auskristallisieren.
Sie können auch einen sauren Ionenaustauscher mit NaCl in die Na-Form überführen, neutral waschen und
dann mit wässriger Essigsäurelösung reagieren lassen. Das Eluat enthält gelöstes Natriumacetat.
IATH + Na+ ———> IATNa + H+
IATNa + CH3COOH ———> IATH + CH3COONa
1018
F: Warum sind eigentlich alle wichtigen Sprengstoffe Stickstoffverbindungen?
Ich suche schon nach einer ganzen Weile nach einer Antwort, aber bisher konnte mir niemand so richtig weiterhelfen...
A: Es gibt zwei Gründe: Sprengstoffe werden (bis auf die ganz modernen)
normalerweise in einem geschlossenen Raum gezündet. Deshalb tragen sie ihren Sauerstoff zur Verbrennung in sich.
Dazu sind vor allem die Stickstoff-Sauerstoff-Verbindungen wie Nitrate (im Schwarzpulver) oder Salpetersäureester
(im Nitroglycerin) oder die Nitro-Aromaten (wie TNT) geeignet. Die zersetzen sich leicht unter Sauerstoffabgabe.
Das können Sie mit einer Salpeterschmelze zeigen. In der verbrennen organisches Material oder Holzkohle spontan.
Hinzu kommt, dass sich bei der Reaktion neben CO2 und Wasserdampf letztlich ein völlig inertes
Gas bildet: Stickstoff. Diese schlagartig bei hoher Temperatur entstehenden Gase sind Ursache für die Explosion.
1019
F: Wir haben auf dem Flohmarkt zwei hübsche glasierte Keramikflaschen
gekauft. Aus den Rissen in der Glasur der mit Essig gefüllten Flasche blüht nun ein Stoff aus, der sich wie
Wachs anfühlt. Er bildet ähnliche Strukturen wie man sie von gefrierendem Tau kennt ("Eisbart") kennt, bisher
ca. 2mm hoch. Wissen Sie, welcher Stoff das sein kann?
A: Ich habe mit Tontöpfen auch schon einiges erlebt. In der
Tschechoslowakei hat man mir mal Bierkrüge angedreht, die nicht glasiert, sondern lackiert waren! Uns
ist beim Trinken daraus richtig schlecht geworden.
Ihre Flohmarkt-Töpfe können ja schon als Behältnisse für Öl oder Schmalz gedient haben. Der Essig
zieht in die Glasur(ritzen) ein und verdrängt das eingezogene Fett. Das dürften Ihre Ausblühungen sein.
Mein Tipp: Entsorgen Sie die Töpfe samt Essig in Mülleimer bzw. Toilette.
Denken Sie auch daran, dass schlechte Glasuren auf Blei-Basis beruhen und Lebensmittel-Säuren das Blei
mobilisieren. Benutzen Sie deshalb niemals glasierte Töpfe aus unsicheren Quellen zur Aufbewahrung oder
zum Servieren von Lebensmitteln - vor allem nicht von sauren! Egal, wie dekorativ die Keramiken auch sein mögen!
1020
F: Ich bin LA-Student und habe im Praktikum zu "Chemischen Schulexperimenten"
folgendes Problem für mich entdeckt:
Es wird ein Versuch durchgeführt, bei dem Ethanol (96%) im Demonstrationsreagenzglas mit Lackmuslösung versetzt
wird und in dieses ein glühendes Kupfernetz eingetaucht wird.
Dabei färbt sich nach mehrfacher Wiederholung die Lackmus-Indikatorlösung von blau nach hellviolett/rosa.
Durch das Erhitzen der Kupferspirale bis zum Glühen, erscheint die typische Kupferfarbe (anstatt
Schwarzfärbung), so dass ich eher annehme, dass die Oxidation des Ethanols auf den physikalisch bzw. chemisch
gebundenen Sauerstoff im Wasser zurückzuführen ist und die Kupferspirale somit "nur" als Katalysator dient.
Demnach wäre die Verwendung der Reaktionsgleichung:
CH3CH2OH + CuO -> CH3CHO + H2O
nicht korrekt, oder?
Vielen Dank für Ihre Mühe beim Durchdenken
A: Denken braucht man da nicht viel. Ihre Gleichung stimmt nicht,
weil Sie das Cu vergessen haben und auch die Weiteroxidation zur Essigsäure nicht berücksichtigt haben. Wo
kommt sonst die Umfärbung des Lackmus her? Für Schüler müssen Sie schon genauer arbeiten.
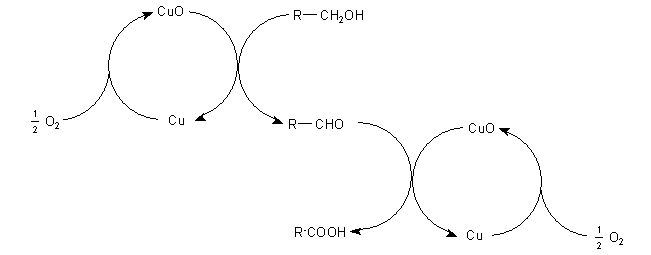
Spaß beiseite: Sie haben aber Recht. Das System Cu/CuO ist Katalysator. Das direkte Oxidationsmittel ist
aber CuO. Wenn Sie genau hinsehen, erkennen Sie, dass die Oberfläche des Kupfers oszillierend changiert. Grund:
Sie wird immer wieder durch die Reaktion Cu + Luftsauerstoff -> CuO "aufgeladen".
Und deshalb sollten Sie diese lineare Gleichung als Kreisprozess formulieren.