 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1067
F: Ich bin Apothekerin. Eine Kundin hatte eine Anfrage bzgl.
phosphatarmer Lebensmittel. Über eine Auskunft zu diesem Thema würde ich mich sehr freuen
A: Phosphat ist in allen Speisen biologischen Ursprungs enthalten,
da es für das Funktionieren von Lebewesen unerlässlich ist. Hier liegen die Gehalte im normalen Bereich.
Darüber hinaus gibt es aber auch Lebensmittelzubereitungen wie Schmelzkäse, Bratwurst oder Colagetränke,
in denen es als erlaubter Zusatz in besonders großen Mengen enthalten ist. Hier spielt es meist die Rolle
eines Emulgators oder Stabilisators.
| Dazu ein paar Werte (Phosphat-Gehalt in mg/100 g): | |
| Weizenkleie | 1200 |
| Milch | 90 |
| Käsesorten | 300-600 |
| Schmelzkäse | 950 |
| Eigelb | 590 |
| Eiklar | 20 |
| Brot | 130 |
| Mehl | 220 |
| Obst | 20 |
| Gemüse | 40 |
| Wurst | 150 |
| Kartoffeln | 50 |
| Fleisch | 20 |
| Fisch | 220 |
1068
F: Leider habe ich im Netz und auch auf Ihrer hervorragenden
Wissensansammlung der Chemie bisher keine Antwort zum Thema: "Edelstahlseifen" (bzw. "Metallseife")
gefunden. Ich meine dieses Stück Seife aus Edelstahl, das den Geruch von den Händen "wäscht". In
einem Forum wurde diskutiert, dass es die oberste Hautschicht entfernt, jedoch wirkt dieses Metallstück
sehr glatt auf mich.
A: Man spricht auch von "Stahlseifen". Das sind Stücke aus
Metall, die geruchsentfernend wirken. Mit denen soll man seine Hände wie mit einem Stück Seife unter
fließendem Wasser abreiben.
Stahlseifen wirken vor allem bei Gerüchen, die von Schwefelverbindungen herrühren. Dazu gehören
zum Beispiel Inhaltsstoffe von Knoblauch oder Zwiebeln. Zur Funktion weiß man nur so viel, dass es
sich um einen katalytischen Effekt handelt. Die Geruchsstoffe werden am Metall adsorbiert und dadurch
aktiviert. Sie werden in diesem Zustand durch Sauerstoff oxidiert und dabei in geruchlose Substanzen
überführt. Diese werden dann abgespült.
Der genaue Mechanismus ist allerdings noch nicht bekannt.
Zum Schluss ein Hinweis: Mit "Metallseifen" bezeichnet man im Allgemeinen die schwerlöslichen Ca- und Mg-Salze der langkettigen Fettsäuren.
1069
F: Kurz gefragt: warum rußen Alkene bei der Verbrennung mehr als entsprechende
Alkane? Die gängige Literatur erklärt das immer mit dem "ungünstigeren" C/H-Verhältnis. Ich verstehe aber nicht,
warum das zu einer unvollständigeren Oxidation des Kohlenstoffs führt...........?
A: Beim Verbrennen werden in der Primär-Reaktion H-Radikale gebildet. Deren
Oxidationsenergie liefert die Aktivierungs-Energie für die Oxidation der restlichen CH-Radikale, die weiter zu
CO2 und H2O verbrennen.
Bei Alkenen und Aromaten entstehen beim Abspalten der H-Atome rascher C-Atome, die sich schnell zu Ruß gruppieren.
Um den zu entzünden, bedarf einer besonders hohen und langanhaltenden Zufuhr von Aktivierungsenergie. Folglich bleibt
der größte Teil unverbrannt.
1070
F: Warum gibt es in der Atmosphäre so viel Argon?
A: Der Gehalt an Argon beträgt knapp 1 Vol%. Dieses Edelgas entsteht
ständig neu aus dem radioaktiven Zerfall des weit verbreiteten Kalium-Isotops K-40. Es handelt sich um den seltenen
Fall der ß+-Strahlung.
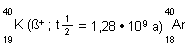
(Hierbei spielt aber auch der K-Einfang eine wichtige Rolle. Bei dem wird ein Elektron aus der K-Schale in
den Atomkern eingebaut. Das Ergebnis ist letztlich das gleiche.)
Da gleichzeitig immer etwas Edelgas in den Weltraum abdiffundiert, bildet sich in der Atmosphäre eine
stationäre Konzentration von Argon aus.
Übrigens gilt Ähnliches auch für Helium. Das entsteht ebenfalls beim radioaktiven Zerfall, und zwar beim Alpha-Zerfall, der bei vielen Actinoiden-Isotopen und anderen Kernen auftritt. Zum Beispiel beim Radon-222
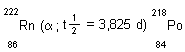
Alphateilchen sind nichts anderes als Heliumkerne. Zusammen mit Elektronen, die beim ß--Zerfall entstehen, bilden sie Helium. Sie tauchen dann vor allem im Erdgas auf.
Weil Helium eine viel geringere Atommasse hat als Argon, reichert es sich jedoch kaum in der Atmosphäre an, sondern entweicht in den Weltraum. Deshalb ist seine stationäre Konzentration von 0,5 Promille (Vol.) vergleichsweise sehr gering.