 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1121
F: Warum riecht Fleisch von Wild oft so fischig? Ist das nicht mehr in Ordnung?
A: Ich denke, dass Sie auf einen aktuellen Fall abheben: Den
Fleischskandal vom Januar 2006 im Musterland Bayern, bei dem auch die Lebensmittel-Kontrollbehörden keine
rühmliche Rolle spielten.
Die Frage lautet also: Was ist der Unterschied zwischen "abgehangen" und "vergammelt"? Letztlich ist das
nur ein ganz schmaler Grat. Bei Wein oder Käse ist das ja bekanntlich anders.
Ich habe selbst einmal auf einer Gesellschaft bei einem passionierten württembergischen Jäger Wild mit
Spätzle und Rahmsauce vorgesetzt bekommen: Zunächst wurde ein mehrere Wochen abgehangener Rehrücken und
später auch noch ein kompletter, entsprechend gealterter Hasenbraten mit Fellpfoten aufgetragen - alles
natürlich mit edlem Lemberger oder Trollinger. Ich habe mich vorher überzeugt, dass die fleischliche
Alterung in einem Kühlhaus erfolgte, und hatte deshalb nur geringe Vorbehalte. (Die Fellpfoten sollen
übrigens als Beweis dafür dienen, dass es sich nicht um die sterblichen Überreste eines Dachhasen handelt.)
Jedoch fand ich beide Fleischproben fischig. Die Jägerfamilie dagegen und deren andere Gäste stuften
das Fleisch besonders lecker ein. Ich hab es dennoch nicht gegessen und damit den Dackel unterm Tisch
gefüttert. Da die Leute und auch der Dackel nach dem Genuss entgegen meiner Erwartung nicht krank wurden,
habe ich dann später das Ganze unter "Folklore" abgelegt...
Nun zur Chemie: Der fischige Geruch stammt von den Aminen, die durch Decarboxylierung aus Aminosäuren entstehen. Hier zum Beispiel die Reaktion der Aminosäure Glycin, die zur Bildung von besonders fischigem Methylamin Anlass gibt.
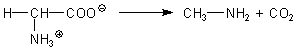
Die Aminosäuren entstehen durch Zersetzung (Hydrolyse) von Fleisch-Proteinen. Ähnliches läuft beim Verderben von Fischen ab. Hier mag man die Ablagerung gar nicht (abgesehen von vietnamesischen Fischsaucen). Sehen Sie in unseren Tipp des Monats "Rechtzeitig zum Urlaub im Süden: Warum man zu Fisch und anderen Meeresfrüchten ein Zitronenscheibchen serviert".
Und warum haben die Kontrollbehörden das nicht gemerkt? Das waren wohl Wildliebhaber: Je fischiger, desto abgehangener und desto edler.
Bei der Abschwächung der mentalen und intellektuellen Fähigkeiten der bayerischen Lebensmittel-Kontrollbehörden wird wohl auch der zum Wildbraten gereichte Wein eine nicht unbeträchtliche Rolle gespielt haben.
1122
F: Kürzlich habe ich den Alkoholnachweis mit Ammoniumcer(IV)-nitrat von
Ihnen übernommen. Mein Versuch, die unterschiedliche Oxidierbarkeit der Alkohole mit diesem einfachen Redoxsystem
zu zeigen, scheiterte jedoch daran, dass sich mein tertiäres Butanol relativ rasch entfärbte, obwohl es eigentlich
nicht oxidierbar sein sollte. Ich vermute, dies liegt an Verunreinigungen. Gibt es Ihrer Ansicht noch weitere
Gründe dafür? Können Sie eventuell ein Reinigungsverfahren vorschlagen, mit dem der tertiäre Alkohol mit
schulischen Mitteln ausreichend gereinigt werden könnte?
A: Es ist nicht richtig, dass t-Butanol nicht oxidierbar ist. Überspitzt
gesagt: Dann würde t-Butanol ja auch gar nicht brennen!
Die Aussage, die Sie wohl meinen, ist die, dass die Oxidation von t-Butanol nicht zu einem eindeutigen Produkt
wie einem Aldehyd (ausgehend von n-Butanol) oder Keton (ausgehend von s-Butanol) führt.
Cer(IV) ist ein so starkes Oxidationsmittel, dass es das t-Butanol-Molekül fragmentiert/zerschlägt, wobei
unterschiedlichste Oxidationsprodukte entstehen. Das kann sogar radikalisch verlaufen und hat dann die Bildung
von Doppelbindungen zur Folge.
1123
F: Ich betreibe seit 15 Jahren Motorsport (Beschleunigungsrennen) und habe
nunmehr ein Problem bei dem Sie mit sicher helfen können.
Durch den erheblichen Einsatz von Lachgas( N2O) habe ich mir einen Kolben (Aluminium) verbrannt
(Loch in der Mitte und Rand). Nichts Problematisches und eigentlich schon leider fast Standard (Motoren mit
ca. 2000 PS), aber diesmal wurde auch die Zylinderwand (Stahl) extrem mit dem Aluminium des Kolbens überzogen.
Nun kam für mich die Überraschung und auch gleich meine Frage. Ein anderes Team hat uns eine stark ätzende
(wahrscheinlich) Säure zur Verfügung gestellt, die das Aluminium von der Zylinderwand aufgelöst hat. Leider habe
ich mir keine Informationen geben lassen.
Welche Säure oder Verbindung ist dazu in der Lage? Kann es sich um Königswasser handeln ? Hierzu habe ich nicht
viel im Netz gefunden, außer das es auch Gold auflöst. Ist es vielleicht schon zu aggressiv und geht auch
die Zylinderwand an?
A: Auf keinen Fall dürfen Sie eine Säure nehmen! Vor allem kein Königswasser!!!
Dann können Sie Ihren Motor gleich wegwerfen, denn Säuren greifen auch den Stahlzylinder an.
Stellen Sie sich stattdessen eine Natronlauge (mindestens 20%ig) her und lösen Sie darin Kochsalz (Natriumchlorid;
ca. 10%ig). Natronlauge zersetzt Aluminium. Chlorid wirkt dabei katalytisch und fördert die Zersetzung. Sie können
auch gleich eine konzentrierte Lösung von Rohrfrei nehmen. Genau hinsehen: Darin befinden sich schon Al-Körnchen,
die in der Mischung zersetzt werden.
Vorsicht: Schutzbrille, alkalienfeste Handschuhe! Nicht rauchen, weil sich Wasserstoff entwickelt.
Lesen Sie zum Rohrfrei unseren entsprechenden Tipp des Monats.
1124
F: Ich plane eine Unterrichtsstunde zum Thema Substratspezifität von Enzymen
am Beispiel der Amylase.
Ich hatte folgende Idee:
1) Nachweis der Stärkespaltung durch Amylase; Nachweis durch Lugolsche Lösung -> funktioniert
2) Als Beispiel eines Substrates, das nicht von Amylase gespalten wird, hatte ich an Cellulose gedacht. Cellulose
kann ja durch Chlorzinkjodlösung nachgewiesen werden. -> Das funktioniert bei Taschentüchern, Watte und z. B. dem
Pulver "Hydroxyethylcellulose"; lila Färbung gut erkennbar.
Problem:
Es soll ja auch ein Versuchsansatz mit Cellulose und Amylase (sowie Indikator) durchgeführt werden. Dazu müsste
man ja Cellulose und Amylase ev. mit Wasser mischen.
Aber: Wenn dieses Cellulosepulver in Wasser gegeben wird, löst es sich nicht. Es löste sich auch nicht, als
ich es in kochendes Wasser gegeben habe. Außerdem färbte sich die Mischung Cellulosepulver + Wasser + einige
Tropfen Chlorzinkjodlösung nicht lila.
Daher habe ich folgende Fragen:
1)Gibt es eine Möglichkeit, Cellulose in Wasser (oder einer anderen Flüssigkeit) zu lösen?
2)Gibt es eine Möglichkeit, GELÖSTE Cellulose nachzuweisen?
3)Funktioniert das mit der Chlorzinkjodlösung?
4)Kann es sein, dass in meinem Fall die Chlorzinkjodlösung zu alt war und aus diesem Grund bei der
Cellulose-Wasser-Mischung keine lila Färbung auftrat (obwohl ja das Cellulose-Pulver nach Zugabe einiger
Tropfen Chlorzinkjod durchaus eine lila Färbung zeigte)?
A: Viele Probleme auf einmal! Cellulose können Sie nicht lösen -
außer in so exotischen Sachen wie Schweizers Reagenz (Ammoniakalische Kupfer(II)-sulfatlösung).
Die Chlorzinklösung können Sie nicht zu Wasser geben; die funktioniert nur in konzentrierter HCl als
Lösemittel; außerdem muss auch das Zinkchlorid sehr konzentriert sein. Deshalb tropft man das Reagenz ja
auch auf die feste Holz- oder Papier-Probe.
Sie können dennoch zeigen, dass die Cellulose nicht angegriffen wird. Schließlich übersteht Filterpapier
den Amylaseangriff, während eine Stärkeemulsion (fast) klar wird.
Zum Nachweis der Amylasewirkung: Setzen Sie in einem parallelen Ansatz ohne Iod auch den Fehling (oder
Benedict) ein. Damit weisen Sie das Produkt nach: Reduzierende Zucker.
1125
F: Was ist der Unterschied zwischen Cyanidin und Cyanin?
A: Es handelt sich grundsätzlich um den roten bzw. blauen Pflanzenfarbstoff
der Rose bzw. der Kornblume. Die allgemeine Bezeichnung dieser Farbstoffe ist Anthocyane (griech. anthos, die Blüte
und griech. kyaneos, blaugrün; Bedeutung etwa "Das Blaugrüne in den Blumen").
In den Pflanzen liegen die Anthocyane als O-Glykoside vor, sind also mit Zuckermolekülen verbunden. Wenn diese
Zuckerreste hydrolytisch abgespalten werden und die phenolische Gruppe freigesetzt wird, so spricht man von Anthocyanidin.
Analoges gilt für Cyanin und Cyanidin.
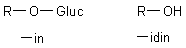
Die Hydrolyse hat übrigens keine Auswirkung auf die Farbe der Pflanzenfarbstoffe.