 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1196
F: Betreff: Natriumchloridbatterie? Was für Reaktionen?
Sehr geehrter Herr Blumen,
wenn ich in ein U-Rohr mit Fritte eine Natriumchloridlösung gebe und in den einen Schenkel eine Kupfer-
und in den anderen Schenkel eine Aluminiumelektrode gebe, kann eine Spannung von ca. 0,5V abgegriffen werden.
Können Sie mir vielleicht sage, welche chemischen Prozesse da ablaufen?
Ein Daniel-Element ist es nicht. Eine Säure ist auch nicht enthalten. Ein Konzentrationselement kommt auch
nicht in Frage.
Ist die Natriumchloridlösung einfach nur das Elektrolyt?
Ich stehe da auf dem Schlauch ... :-(
A: Es empfiehlt sich, bei unbekannten Elementen zuerst die
Gesamtreaktionsgleichung des vermuteten Redoxprozesses zu formulieren. Hier handelt es sich um eine durch
Kupfer und durch Chlorid-Ionen katalysierte Reaktion von Al mit dem Wassersystem. Formal gilt für dieses Lokalelement:
2 Al + 6 H2O ———> 2 Al(OH)3 + 3 H2 (Katalysatoren Cu und Cl-)
Sie haben die Reaktionsräume in Oxidations- und Reduktionsteil getrennt und damit eine Art von Volta-Element hergestellt.
Die Fritte als trennendes Diaphragma benötigen Sie deshalb gar nicht, da sich in beiden Reaktionsräumen die
gleiche Lösung befindet. Bleibt die Frage nach den Protonen. Deren Konzentration auch in neutraler Lösung wird
unterschätzt. Sie reichen für eine der beiden potentialaufbauenden Reaktionen aus:
2 H+ + 2 e- ———> H2 (an der Oberfläche der Cu-Elektrode)
Die andere Reaktion ist unter anderem (katalysiert durch Chlorid-Ionen)
Al + 3 OH- ———> Al(OH)3 + 3 e-
Allerdings werden Sie von Ihrer "Natriumchlorid-Batterie" keine allzu großen Leistungen erwarten können, da der Stromfluss doch zu gering ist.
Lesen Sie hierzu unseren Tipp März 1999. Dort wird das Phänomen im Zusammenhang mit der Al-Korrosion genau untersucht.
1197
F: Was halten Sie von Versuchen zur eigenen Herstellung von kosmetischen
Artikeln, auch in der Schule?
A: Nichts, sonst hätten wir dazu schon einiges gebracht. Denn in der
Literatur strotzt es von Hinweisen zur Herstellung der Kosmetika. Ich erinnere auch an die sagenhaften Bücher
von Jean Pütz.
Auch in unseren eigenen Büchern haben wir - ein wenig unter dem Druck der Schulen - Rezepte zur Herstellung
von Salben und Lippenstiften beschrieben. Gilt doch das Selbstherstellen "als geeigneter und motivierender Zugang
zu chemischen Phänomenen".
Zunächst ist die Rohstoffbeschaffung sehr schwierig. Denn Kosmetikfirmen mauern, wenn man sie als Lehrer um Mithilfe bittet. Warum?
Nicht umsonst unterliegen kosmetische Artikel dem Lebensmittelrecht. Problematisch wird es, wenn die SchülerInnen die Artikel, die sie im Chemieunterricht hergestellt haben, selbst ausprobieren wollen oder sogar verschenken. Denn kosmetische Artikel werden direkt auf unsere Haut aufgetragen, kommen sogar mit Schleimhäuten in Kontakt und können sogar geschluckt werden.
Wenn man die Chemikalien dann endlich in Bioläden oder Bastelgeschäften erworben hat, so stellt sich die Frage, wie
rein diese Substanzen sind. Aber auch das hilft nur begrenzt: Auch unter den reinen Substanzen befinden sich häufig
Allergene, also Stoffe, die Allergien auslösen können.
Weiterhin muss bei der Herstellung äußerste Sauberkeit gewährleistet sein - in einem Schullabor eine unerfüllbare
Anforderung. Dazu müssen kosmetische Artikel unter sterilen Bedingungen hergestellt werden. Denn sie neigen wie
Lebensmittel bei Eintrag von Mikroorganismen sehr rasch zur Verderbnis. Auch Luftabschluss ist förderlich, denn
Sauerstoff und Feuchtigkeit sorgen ebenfalls für frühe Verderbnis der Produkte. So kann eine Hautcreme (und damit
auch der Nutzer) rasch ranzig riechen.
Letztlich ist die Vermittlung chemischer Inhalte bei der Herstellung von kosmetischen Artikeln äußerst dürftig. Es handelt sich um reines Mischen von Substanzen, deren Namen man kaum kennt, geschweige denn die chemische Zusammensetzung. Oder um Kochrezepte. Dann könnte man einen Malkurs ebenfalls zum Chemieunterricht erklären. Oder einen Kochkurs!
1198
F: Bei der Behandlung des "einfachen" Born-Haber-Kreisprozesses ist den
SchülerInnen der eigentliche Elektronentransfer nicht einfach zu vermitteln. Sie lernen, dass die Ionisierung des
Natrium Energie erfordert, bei der Aufnahme des Elektrons durch das Chlor Energie frei wird, wie das Elektron
aber vom Na zum Cl transportiert wird, ist unklar.
Gehe ich Recht in der Annahme, dass beim Stoß der Na- und Chlor-Atome in der Gasphase für einen kurzen Augenblick
ein "Ionenpaar" entsteht, dass auf der Stelle mit anderen Ionenpaaren zum Gitter kondensiert? Gibt es Untersuchung
hinsichtlich der Geschwindigkeit, mit der dieser Prozess abläuft?
A: Es entstehen in der Reaktionshitze primär nicht nur Ionenpaare, sondern
nachweisbar sogar auch echte, kovalente NaCl-Moleküle. Die bilden sich auch, wenn NaCl siedet. Man sollte also mit
dem einfachen Modell der Ionenbindung beim NaCl vorsichtig sein. Aber m. E. hat das Schüler "nicht zu interessieren"...
Die sind schon verwirrt genug.
Ansonsten haben Sie mit der Vorstellung, dass diese dimeren "Teilchen" unter Energiefreisetzung zum Natriumchlorid-Gitter
kondensieren, Recht.
Dazu gibt es natürlich viele - vor allem spektroskopische - Untersuchungen. Da müssten Sie aber bitte selbst recherchieren.
1199
F: Ich bin Lehrerin an einem Gymnasium und wurde nach folgender Verbindung gefragt
(Name,Verwendung,Bildung)
"Ti[OCH(CH3)2]4"
Können Sie helfen?
A: Der Name der Substanz ist Tetra-isopropyl-titanat.
Dieser flüssige Stoff gehört formal zur Gruppe der so genannten Titansäureester. Mit Wasser und entsprechenden anderen
Substanzen bildet er TiO2. Man benutzt ihn zur Beschichtung von Oberflächen, die Eigenschaften haben wie
imprägnierende Wasserabweisung, Bindungsfähigkeit zu Alkyd- und Epoxidharzen. Sie entwickeln zusätzlich aber auch
katalytische Fähigkeiten. Das gilt vor allem für Olefin-Polymerisationen.
Das abgeschiedene Titandioxid ist weiter ein typischer Vertreter der Nanotechnologie und kann z. B. unter Bestrahlung
Loch/Elektron-Paare bilden, die hervorragende Redoxkatalysatoren sind und z. B. zur Desodorierung von Raumluft eingesetzt werden.
Wichtig ist auch der Einsatz in der Medizin: Da sich das TiO2 aus dem Ester sehr fein abscheidet, werden zusammen mit analogen SiO2-bildenden organischen Siliciumverbindungen äußerst feinporige, aber zugleich sehr stabile Körper-Implantate hergestellt, in die das umgebende Zellgewebe sehr gut einwandern kann.
1200
F: Ich habe eine Frage zu dem Thema Chlorbleiche und zwar:
Nach meinem Wissen beruht die Bleichwirkung von Chlor auf einen Angriff auf die konjugierten Pi-Elektronensysteme
indem sich Chlor an die Doppelbindungen anlagert.
Meine Frage betrifft jetzt den Indanthrenfarbstoff. In meinem Versuch wurde Chlorophyll und Anthrocyan entfärbt,
Indanthren jedoch nicht (oder zumindest nicht so stark), die Druckerschwärze gar nicht.
Ich habe gelesen, dass Indanthren so synthetisiert wurde, dass es Chlorresistent ist. Aber was macht es resistent?
Denn nach meinen Recherchen hat es auch konjugierte Pi-Bindungen.
Und wissen sie die Struktur von Harz? Die wäre nämlich wahrscheinlich für eine Erklärung, dass die Druckerschwärze
gar nicht angegriffen wird hilfreich.
A: Zunächst zum Einfachsten: Druckerschwärze besteht aus Ruß (also
mikrokristallinen Graphit), und den kriegen Sie mit Chlor nicht geknackt...
Chlor wirkt zweifach:
A. Substitution
Bei den Anthocyanen handelt es sich um Phenole, also um aktivierte Aromaten, die in o- oder p-Stellung leicht
chloriert werden können.
Beim Indanthren, das sich vom Anthrachinon (selbst ein hellgelber Farbstoff) ableitet, ist das anders. Das
folgende Bildchen zeigt die Struktur des blauen Farbstoffs, der sich u. a. auch beim bekannten Versuch der
KNO3-Schmelze mit Holzkohle bildet.
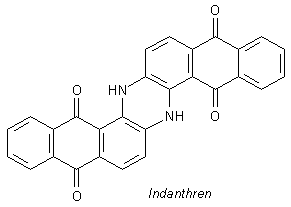
Wir sehen, dass die Benzolringe eher singulär stehen. Die Aminofunktionen wirken nicht so aktivierend auf das aromatische System und deshalb verhält sich der Farbstoff gegen den Angriff von Chlor stabiler.
B. Oxidation
Chlor bildet in Wasser Hypochlorit, das über die Freisetzung von Sauerstoffatomen sowie Bildung von OH-Radikalen
und Wasserstoffperoxid auf die Substanz oxidierend wirkt. Hier gilt das Gleiche wie oben gesagt. Außerdem kann es zur
oxidativen Spaltung von Bindungen kommen - auch beim Indanthren.