 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
236
F: Zur Zeit schreibe ich im Leistungskurs Chemie eine Facharbeit über
das Thema "Nachwachsende Rohstoffe - Chitin, Chitosan". Wie Sie vielleicht wissen, ist es mit Chitosan
möglich, Schwermetalle aus Abwässern zu entfernen. Dies möchte ich gerne mit Cadmium beweisen, da dieser
sehr häufig eingesetzt wird, z.B. in Batterien. Jedoch fehlt mir hierzu eine (schultechnisch durchführbare)
Reaktion, mit der man den Cadmiumgehalt bestimmen kann (bei Kupfer ist dies mit Hilfe eines Fotometers möglich).
A: Dass Chitosan bei der Abwasserreinigung als Ionenaustauscher
genutzt wird, weiß ich. Dazu haben wir ja auch einen Versuch.
Für halbwegs quantitative Analysen empfehle ich eine Anfrage an die Fa. Merck, die zu fast jedem Ion
ein Nachweis-Set hat. Für den qualitativen Nachweis fällen wir mit H2S oder Na2S-Lösung gelbes CdS.
Die Versuchsvorschrift findet sich im Versuch 45 "Qualitative Abtrennung von Cadmium-Ionen durch
Ionenaustausch" in unserer Webseite "Ionenaustauscher".
237
F: Können Sie mir bitte bei folgender Formel weiterhelfen? Ba(NO3)2.
Was sagt diese Formel aus?
A: So genau weiß ich nicht, was Sie mit der Frage meinen.
Ich versuch's einmal und gehe davon aus, dass Sie einen Behälter haben, auf dem das draufsteht, und nicht
wissen, was das bedeutet.
Der Stoff heißt Bariumnitrat. Er wird genutzt als Farbträger bei Feuerwerkskörpern. Er ist giftig und
fördert (wie alle Nitrate) die Verbrennung. Also vorsichtig damit umgehen. Er darf auch nicht erhitzt werden.
238
F: Bin auf der Suche nach Informationen zur Verbrennung von Benzin
auf Ihren Seiten fündig geworden. Es geht darum, vorübergehend, aus einer Notsituation heraus, in der
Küche (u. U. unter einen aktiven Abzug) einen Expeditionskocher zu betreiben, der mit Gas, Benzin, Diesel
oder Petroleum gefüttert werden kann. Außerdem sollte man ja generell über die Gefahren solcher Teile
Bescheid wissen.
Welche Abgase entstehen bei der Verbrennung von Butan-/Propan-Gemischen, bzw. Reinigungsbenzin aus der
Drogerie? Hat es Zweck, dies unter einer Abzugshaube zu tun, oder sind die Abgase vielleicht schwerer als Luft?
Welche Unerschiede und Gefahren gibt es bezogen auf die unterschiedlichen Brennstoffe?
A: Wenn Sie den Expeditionskocher im Küchenraum offen betreiben,
also ohne Anschluss an einen ziehenden Kamin, spielen Sie mit Ihrem Leben. Das betrifft zunächst die Abgase,
die nicht abziehen. Mit dem Abziehen wird ja Frischluft zugeführt. Somit haben Sie unvollständige Verbrennung
und eine hohe CO-Gefahr.
Hinzu kommt, dass die Brennstoffe verdampfen und hohe Explosionsgefahr besteht. Die Abgase sind übrigens
schwerer als Luft.
239
F: Ich habe Ihren Text über die Dichteanomalie von Wasser mit grossem
Interesse gelesen. Dabei tauchte allerdings eine Unklarheit auf. Im zweiten Abschnitt steht: "...steigt die
Temperatur mit der Tiefe des Sees an, um bei etwa 1.20m stehen zu bleiben." Handelt es sich bei den 1.20m
um einen Druckfehler, denn es erscheint mir recht unlogisch, dass das Wasser bei dieser Tiefe schon
einen solchen Druck erreicht?
A: Bei 1,20 m Tiefe übt die Wassersäule bereits einen Druck von
0,12 atm (ungefähr 0,122 bar) auf das darunter liegende Wasser aus. Das ist soviel, dass Sie in dieser Tiefe
zum Beispiel nicht mehr schnorcheln können, weil Ihr Brustkorb so zusammengedrückt wird, dass Sie nicht mehr
selbständig atmen können. Deshalb muss Ihre Atmung mit entsprechenden Tauchgeräten mit hohem Gegendruck
unterstützt werden (Aqualunge).
Diese Anomalie und die damit verbundene Kälte von 4 °C wirken sich zum Beispiel in der Gefährlichkeit
von Baggerseen aus; es ist bekannt, dass das austauscharme Wasser von Baggerseen trotz warmer Oberfläche
schon bei etwa 1,50 m Wassertiefe dermaßen kalt ist, dass erhitzte Personen, die hineinspringen, darin einen
Herzschlag aufgrund des Kälteschocks erleiden können.
240
F: Ich studiere in Oldenburg Lehramt für Biologie und
Chemie. Bei meinen Recherchen bin ich auf ihren Artikel "Warum leuchtet
Tonic Water in der Sonne" gestoßen, den ich sogleich mit Begeisterung
gelesen habe. Der Grund, weshalb ich mich direkt an Sie wende ist der, dass
morgen eine Biologiestunde geplant werden soll, in der Chinin als
Bitterstoff eingesetzt werden soll und die Zeit knapp wird. Leider ist diese
Substanz nicht in den "Richtlinien zur Sicherheit im naturwissenschaftlichen
Unterricht" aufgeführt und der zuständige Gemeindeunfallverband ist auch
keine Hilfe. Weiterhin kursieren unbestätigte Gerüchte, dass Chinin für den
Einsatz im Schulunterricht gänzlich verboten ist.
Zur Anwendung: Thema der Stunde ist die menschliche Zunge und in
Partnerarbeit sollen sich die Schüler Substanzen der unterschiedlichen
Geschmacksqualitäten mit einem Wattestäbchen auf unterschiedliche Stellen
der Zunge aufbringen. Ziel ist eine kritische Auseinandersetzung mit der
althergebrachten "Zungenkarte".
Folgende Fragen sind daher für mich offen:
1. Darf Chinin in der Schule (Niedersachsen / 7. Klasse) eingesetzt werden?
2. Wenn ja, in welchen Konzentrationen?
3. Wenn nicht, welche Ersatzstoffe kämen in Betracht und sind leicht zu
beschaffen?
A: Sie können Chinin verwenden, aber
nur in extremer Verdünnung! Testen Sie das am besten vorher an sich selbst. Andere
Bitterstoffe sind zum Beispiel in der Bittermandel enthalten; deren Anwendung in der
Schule ist aber zu gefährlich. Aber auch der Sud der Galläpfel enthält genügend Bitterstoffe.
Geeignet sind auch die Tannine, die auch im bitteren Tee vorkommen.
241
F: In Ihren Webseiten habe ich interessante
Anleitungen zu chemischen Schulversuchen gefunden- u.a. auch eine Anzahl von Redoxreaktionen
mit Hydrochinon. Seit Wochen suche eine Auswahl von pH-abhängigen Redoxpotentialen des
Hydrochinon/Chinon-Systems. Außer den Angaben bei pH=0 von E = 0,70 V habe ich weder
Konzentrationsangaben zur fotographischen Entwicklersubstanz noch exakte pH-Werte gefunden.
Ich wäre Ihnen sehr dankbar, wenn Sie mir Hinweise zu möglichen Quellen bzw. konkreten
Daten geben könnten.
A: Sie haben ein kompliziertes System in Arbeit...
Das Redoxpotential des Hydrochinon (H2Q)/Chinon (Q)-Systems ist pH-abhängig, wie schon die
Reaktionsgleichung ahnen lässt:
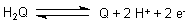
Dazu bildet H2Q mit Q einen dunkelgefärbten (1:1)-Charge-Transfer-Komplex namens Chinhydron, dessen Gleichgewichtspotential direkt pH-abhängig ist:
Man nimmt deshalb die Chinhydron-Elektrode auch als Eich-Elektrode anstelle einer
Standardwasserstoff-Elektrode.
Ich weiß weiterhin allerdings nicht, was Sie genau vorhaben. Bezüglich Zusammensetzung und pH-Wert
des Entwicklers fragen Sie am besten beim Hersteller nach. Wenn Sie unsere Rezepte verwenden (->
Fotografie-Webseiten), stellt sich diese Frage natürlich nicht. Den pH-Wert können Sie auch
selbst messen.
Erschwerend ist, dass durch die Hydrogensulfit-Ionen das Chinon sulfoniert wird und auch andere
Entwicklersubstanzen wie Methol eine Rolle spielen. Alle zusammen beeinflussen natürlich das Redoxpotential
des Entwicklers.