 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
242
F: Durch eine Gaswaschflasche mit Kalkwasser wird eingeatmet und in eine andere
Flasche wird ausgeatmet. Was kann man beobachten ? Erklärung?
A: Kalkwasser ist ein Nachweismittel für Kohlenstoffdioxid CO2.
Es bildet sich dabei weißes Calciumcarbonat.
Ca(OH)2 + CO2 ———> CaCO3 + H2O
Beobachtungen:
Durch eine Flasche einatmen: Es passiert (fast) nichts. Du beobachtest höchstens eine ganz schwache Trübung.
In das Wasser ausatmen: Die Lösung trübt sich stark.
Erklärungen:
Der Versuch zeigt, dass in deinem Körper CO2 entsteht, das du dann ausatmest. Die schwache
Trübung beim Einatmen zeigt darüber hinaus, dass in der Luft immer ein wenig CO2 vorhanden ist.
Pro Tag atmest du übrigens etwa 1 kg des Gases CO2 aus. Das sind rund 500 Liter.
243
F: Wie erreiche ich schnellstmöglichst, dass Eisen rostet?
Gibt es ein chem. Mittel? Ein Freund von mir will, dass es "alt" (antik) aussieht.
A: Dazu muss er das Eisenstück zunächst mit Alkohol/Brennspiritus gut
entfetten. Dann taucht er das Eisenstück in verdünnte Natronlauge (oder Rohrfrei-Verdünnung; Vorsicht! Stark ätzend!!)
und lässt es feucht längere Zeit an der Luft liegen. Man kann auch eine konzentrierte Kochsalzlösung nehmen.
Das Rosten sollte schnell vonstatten gehen. Danach gut abspülen und ohne zu reiben trocknen lassen.
Die Vorschrift versagt natürlich, wenn es sich um rostfreien Stahl handelt!
244
F: Warum ist der siedepunkt und der gefrierpunkt vom druck abhängig?
A: Beim Sieden wird aus einem kleinen Volumen ein riesiges. Aus 18
ml flüssigem Wasser werden zum Beispiel 30 600 ml Wasserdampf. Beim Sieden versuchen Teilchen/Moleküle aus
der Flüssigkeit in den Luftraum darüber zu gelangen. Du wirst einsehen, dass sie dabei gegen die Luftteilchen
stoßen. Je weniger es davon gibt, desto leichter gelingt das. Und mit sinkendem Luftdruck ist die Zahl der
Teilchen eben geringer!
Beim Gefrieren/Kristallisieren ist der Effekt nicht so deutlich, da sich das Volumen bei den üblichen
Stoffen nicht sonderlich ändert. Üblicherweise nimmt das Volumen etwas ab. Ein flüssiger Stoff wie
geschmolzenes Eisen "gefriert" eher, wenn er unter hohem Druck steht. So ist das Eisen im Erdkern wegen
des hohen Drucks trotz der hohen Temperaturen von etwa 5000 °C fest und liegt zusammen mit Nickel
oktaedrisch kristallin vor.
Anders ist es beim Wasser: Beim Gefrieren nimmt sein Volumen um etwa 10 % zu, weil die Wassermoleküle
im Eis eine sperrigere Struktur einnehmen als im flüssigen Wasser. Wenn der Druck steigt, gefriert Wasser
also nicht, weil es die sperrigere Struktur schlechter aufbauen kann. Sinkt dagegen der Druck, gefriert
es schon bei höheren Temperaturen.
245
F: Ich habe bei Ihnen den besten Beitrag zur Entstehung von Silex
gelesen! Es war wie so oft beim Recherchieren im Netz, dass man den besten Beitrag am Ende und kurz vor
dem Aufgeben findet.
Eine Frage bewegt mich aber immer noch, auf die ich auch noch keine plausible Antwort gefunden habe.
Vielleicht können Sie mir weiter helfen. Warum heißt nun der Feuerstein eigentlich Feuerstein, wo er doch
gar kein Feuer erzeugen kann, sondern nur Hilfsmittel ist um aus dem Pyrit oder Stahl Funken zu schlagen?
A: Zunächst freue ich mich über Ihr Lob über unsere
Silex/Flint/Feuerstein-Webseiten.
Zu Ihrer Frage bezüglich des Namens: Die Altvorderen aus der Steinzeit, die den Feuerstein wohl
so benannt haben, haben sich um semantische Feinheiten, die Sie entwickeln, kaum gekümmert. Für die war
der Flint/Silex derjenige Stein, mit dem man Feuer machte, vor allem, weil er ja beim Zusammenschlagen
auch noch so geheimnisvoll leuchtet. Von der Nichtzündfähigkeit der Tribolumineszenz haben die sicherlich
noch nichts gewußt. Dass man zum wirklichen Zünden noch Markasit und außerdem den Zunderschwamm gebrauchte,
war denen wohl egal. Für die war zum Zünden der Feuerstein offenbar das Wichtigste.
Übrigens heißt der Pyrit aus dem Griechischen übersetzt auch Feuerstein. Weiter gibt es noch das Mineral Pyrolith. Das ist der Stein, der im Feuer (des Vulkans) entstanden ist.
246
F: Seit kurzem behandeln wir in Chemie das Thema "Änderungen beim
Erhitzen von Stoffen". Daher möchte ich Sie fragen, ob sie mir kurz auflisten können, welche Stoffeigenschaften
das Metall Kupfer hat. Es wäre wirklich sehr nett, wenn sie mir eine Liste zuschicken könnten.
A: Alle die folgenden Eigenschaften entfallen beim starken Erhitzen
bzw. Glühen an der Luft:
Kupfer hat eine hohe Dichte, ist also ein Schwermetall, ist weich, gut verformbar, hat eine rötliche Farbe,
glänzt bei sauberer Oberfläche, hat eine sehr gute elektrische Leitfähigkeit und Wärmeleitfähigkeit.
Es ist relativ edel.
247
F: Ich brauche HIIIILFE !! Das ist die Aufgabe für eine
klausur am Freitag , und ich bin PLANLOS : 174 mg einer organischen Flüssigkeitz verbrennnen mit O2
und CuO zu 396 mg CO2 und 162 mg H2O . Dieser Stoff enthällt auch Sauerstoff
(qualitative Analyse mit Mg) 232 mg der Flüssigkeit verdunsten zu 96ml = 4*24ml Gas . stellen sie die
Summenformel auf ( von Aceton , aber das soll ja erst herausrechnen ) Wenn sich ein Genie angesprochen fühlt
... hier ist was zu knobeln.
A:
396 mg CO2 sind 396 : 44 = 9 mmol
162 mg H2O sind 162 : 18 = 9 mmol.
Die Molmasse der Substanz ist aus der Gasmenge zu berechnen. Bei 20 °C hat ein mmol Gas ein Volumen
von 24 ml.
Also: In 96 ml sind 96 : 24 = 4 mmol Gas. Das entspricht 232 mg verdampfter Substanz. Teile
somit 232 durch 4 = 58. Das ist die Molmasse der Substanz.
In 174 mg sind 174 : 58 = 3 mmol enthalten.
Die Reaktionsgleichung ist
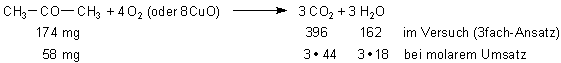
Die Substanz ist tatsächlich Aceton.
248
F: Welche Bestandteile sind in Calciumcitratpulver enthalten.
Ich bin Tierbesitzer und füttere frische Kost die ich ab und an mit Calciumcitrat anreichere um
Calciummangel vorzubeugen. Nun stellte sich für mich die Frage, wenn in 100 g Calciumcitrat ca. 21%
Calcium enthalten sind, was ist der Rest, leider konnte ich nirgendwo eine befriedigende Antwort
erhalten und bin auf Ihre äusserst interessante und informative Homepage gestossen und habe mir
erlaubt Sie in Zuge der Fragestellung zu kontakten. Ich hoffe Sie nehmen es mir nicht übel und
wäre Ihnen sehr dankbar, wenn ich hierüber Aufklärung erhalten könnte, da ich keine entsprechende
Fachliteratur und Kenntnisse besitze.
A: Ich gehe davon aus, dass es sich um das handelsübliche
tri-Calciumdicitrat-Tetrahydrat handelt. Molmasse: 570,51 g/mol. Molmasse Ca: 40,08, Molmasse Wasser: 18.
| Ca-Gehalt: | (570,5 / 3 · 40,08) · 100 = 21,1 % |
| Hydratwasser: | (570,5 / 4 · 18) · 100 = 12,6 % |
Der Rest (66,3 %) ist ungiftige dissoziierte Citronensäure (also deren Tri-Anion), bestehend aus den Elementen C, H und O. Insgesamt eine gesunde Mischung für Tier und Mensch.