 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1386
F: Es geht um das unterschiedliche Verhalten von Biphenyl und Fluoren
bei Bestrahlung mit UV. Warum fluoresziert Fluoren, nicht aber Diphenyl? Und wie ist das mit dem Antracen,
das ja auch eine starke Fluoreszenz zeigt.
A: Bei der Absorption von UV werden Elektronen angeregt. Ein Teil
dieser Energie wird zur Erregung von Schwingungen abgezweigt. Beim Diphenyl (oder Biphenyl) kommt noch die
Rotation der beiden Ringe um die gemeinsame Bindungsachse hinzu. Auf diese Weise wird die eingestrahlte
Energie förmlich verschluckt und in kinetische Energie umgewandelt. Man kann messen, dass die Moleküle
bei Bestrahlung „wärmer werden“.
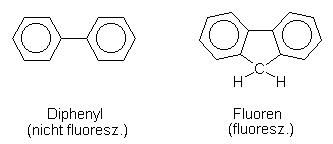
Beim Fluoren dagegen sind die Ringe durch die zusätzliche Methylenbrücke am Rotieren gehindert. Schwingungen sind aber möglich. Deshalb wird ein Teil der eingestrahlten Energie als Strahlungsenergie zurückgegeben. Da ein Teil der ursprünglich eingestrahlten Energie verbraucht wurde, ist die ausgestrahlte Strahlung im sichtbaren Bereich (Blauviolett) angesiedelt.
Beim Anthracen ist es ähnlich. Bei Bestrahlung mit unsichtbarem UV werden im Molekül Schwingungen angeregt; die restliche Energie wird als sichtbares Licht zurückgegeben.
1387
F: Hallo,
In meinem Leistungskurs Bio kam neulich die Frage auf wie wichtig die einzelnen Teilvorgänge der Glykolyse
energetisch gesehen sind und. Besonders bei den Vorgängen: wenn aus Glucose-6-Phosphat Fructose-6-Phosphat
wird und wenn 3-Phosphoglycerat zu 2-Phosphoglycerat wird.
Genau zu diesen beiden Vorgängen, besonders zu letzterem, kam auch die Frage auf welchen Vorteil der
Körper von der reinen Umlagerung von den jeweiligen Gruppen eigentlich hat.
Eine weitere Frage die gestellt wurde war. Bei der Spaltung von Fructose-1,6-diphosphat entsteht neben
Glyceral-3-phosphat auch Glyceron-3-phosphat. Aber nur Glyceral-3-phosphat kann direkt weiter reagieren,
Glyceron-3-phosphat muss erst wider durch ein Enzym umgewandelt werden. Hat es für den Körper einen Vorteil
Glyceron-3-phosohat herzustellen und nicht gleich ein weiteres Glyceral-3-phosphat, oder ist es chemisch nicht
anders möglich.
Ich hoffe es sind nicht zu viele Fragen auf einmal.<
A: Grundsätzlich: Viele vor allem reversible Reaktionsschritte verfeinern
die Steuerbarkeit der Glykolyse.
Ad 1: Gluc-6-P wird zur Fruc-6-P und weiter zu Fruc-1,6-DiP, damit später bei der Aldolase-Reaktion eine Spaltung in GlycAld-3-P und in Dihydroxy-Aceton-P (= Glyceron-3-phosphat) erfolgen kann. Obwohl diese Reaktion in ein Gleichgewicht mündet, das bei 95 % auf der Seite des Glycerons liegt, läuft sie so ab. So merkwürdig es klingt: Dieses Ungleichgewicht ermöglicht aufgrund der Reversibilität eine besonders feine Steuerung der Glykolyse.
Ad 2: 3-P-Glycerat wird zu 2-P-Glycerat – warum?
Diese reversible Umlagerung erfordert keine zusätzliche Energie und ist energiekonservierend. Anschließend wird
von 2-P-Glycerat Wasser abgespalten. Es bildet sich 2-P-Enolpyruvat.
Es handelt sich bei einem Enol um eine sauer reagierende funktionelle Gruppe (vergleiche die Struktur der Ascorbinsäure).
2-P-Enolpyruvat ist also kein Phosphorsäure-Ester, sondern ein gemischtes und daher hochenergetisches Säureanhydrid. Außerdem
ermöglicht dieser Schritt nach P-Abspaltung (unter ATP-Gewinn) die Umlagerung im Sinne einer Keto-Enol-Tautomerie. Nur so
bilden sich Pyruvat und anschließend Acetyl-CoA für den weiteren oxidativen Abbau bzw. Aufbau von Fettsäuren (etc.).
1388
F: Wir färben mit Berliner Blau. Wie haftet der Farbstoff auf der Faser? Warum
wird der Farbstoff durch Zugabe von einer Lauge entfärbt?
A: Die Formel von „unlöslichem“ Berliner Blau ist chemisch FeIII
[FeIIFeIII(CN)6]3.
Der Farbstoff wird in Gegenwart der Fasern hergestellt. Er haftet (übrigens nicht sonderlich gut) auf der Faser,
weil der Niederschlag die Faser quasi einschließt.
Berliner Blau wird durch OH--Ionen zerstört, weil sich Eisen(III)-hydroxid bildet. Da braunes Eisenhydroxid entsteht, kann man eigentlich nicht von einer Entfärbung sprechen. Aber der blaue Farbton ist wesentlich intensiver als das helle Braun.
Wir haben zum Berliner Blau eine Webseite im Webbereich „Komplexe“: Cyanokomplexe des Eisens: Die Blutlaugensalze. Da wird beschrieben, was chemisch dahinter steckt.
1389
F: Unser Honig ist auskristallisiert. Wie kann ich ihn wieder flüssig machen?
A: Erwärmen Sie ihn nicht direkt auf der Herdplatte oder über der Gasflamme,
da er sich dabei leicht zersetzt. Am besten ist es, wenn Sie das Honigglas so lange in einem Wasserbad erhitzen, bis
Sie keine Kristalle mehr sehen. Das dauert aber etwas! Danach ist er wieder wie frisch.
Dahinter steckt Folgendes: Honig ist eine übersättigte Lösung von Zuckern. Wenn er länger steht, bricht dieses
metastabile System zusammen; es kommt zur Kristallisation. Durch das vorsichtige Erhitzen stellen Sie das metastabile
System wieder her.
1390
F: Ich möchte mit Schülern des 11. Jahrgangs ein Schülerexperiment zur Hemmung
von Katalase (Kartoffelscheibe) mit Kupfersulfat durchführen. Der Versuch funktioniert sehr gut: nach sehr kurzer
Einwirkdauer (1-2 Min) schäumt die mit Kupfersulfat behandelte Kartoffel kaum noch. Ich habe nun gesucht und bisher
nur als Erklärung gefunden, dass entweder das aktive Zentrum blockiert wird (kompetitive Hemmung) oder die Kupferionen
sich irgendwo anders (nicht im aktiven Zentrum) anlagern und dadurch die Konformation des Enzyms ändern.
Gibt es da genauere Erkenntnisse, um welche Hemmung durch Schwermetalle, speziell bei Kupfer, es sich bei der Katalase
handelt?
A: Meines Wissens nach gibt es da keine Untersuchungen. Denn es ist bei einem
riesigen Molekül wie der Katalase überhaupt schwer zu sagen, wo das hemmende Cu(II)-Ion andockt. Dazu gibt es viele
Möglichkeiten: SH-Gruppen, Aminogruppen usw. Denn Cu(II) ist ein guter Komplexbildner; außerdem bildet es sulfidartige
Mercaptide. Auf jeden Fall reicht die dadurch ausgelöste Konformationsänderung des Proteins aus, um seine enzymatische
Wirkung zu blockieren.
Ähnliches gilt auch für die noch größere Urease. Man kann zeigen, dass 4 Silber-Ionen pro Molekül zum Blockieren ausreichen. Und das bei einer Molmasse von 550.000 u!