 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1391
F: Da ich die Antwort auf meine Frage nicht auf Ihrer Homepage gefunden habe,
hoffe ich, dass Sie damit noch nicht konfrontiert wurden.
Ich habe mit dem Versuch - Schwimmende Kerze in einer Glaswanne und dann Standzylinder über die Kerze stülpen
- meinen Schülern auf einfachem Wege den Sauerstoffgehalt der Luft nachgewiesen. Der Versuch klappt immer gut und
die Schüler verstehen, dass der Sauerstoffanteil der Luft 1/5 ist.
Jetzt meine Frage: Warum steigt der Wasserspiegel um 1/5, nachdem die Kerze ausgegangen ist. Es wird zwar Sauerstoff
verbraucht , aber es entsteht ein neues Gas (Kohlenstoffdioxid). Warum steigt dennoch der Wasserspiegel im Standzylinder
um diese 1/5?
A: Bedenken Sie, dass die bei der Verbrennung von Kohlenwasserstoffen entstehenden
Gase vor allem CO2 und Wasserdampf sind. Nehmen wir zum Rechnen modellhaft einen einfachen, flüssigen
Kohlenwasserstoff: Pentan.
C5H12 + 8 O2 ———> 5 CO2 + 6 H2O
Sie sehen, dass sich das Gasvolumen verändert: Aus 8 mol Gas werden 11 mol Gas. (Das Volumen des flüssigen Pentans
können wir vernachlässigen.)
Das Ansteigen des Wasserspiegels liegt einmal am Abkühlen des zunächst heißen Gasraumes über und um die Kerze. Dabei
verschwindet ein Teil das Gases relativ plötzlich: Der Wasserdampf wird bei Kontakt mit der Wasseroberfläche ebenfalls
zu flüssigem Wasser. Das sorgt für eine noch stärkere, fast ruckartige Volumenabnahme. Hinzu kommt noch die Löslichkeit
des CO2 in Wasser.
1392
F: Explosionsgefahr bei Wasserzersetzungsküvetten mit Pt-Elektroden?
Für Schülerexperimente sind seit einiger Zeit Wasserzersetzungsgeräte (Küvettentechnik) aus Kunststoff erhältlich.
Meine Frage:
Ist es theoretisch möglich, dass das beim Umkippen entstehende Knallgasgemisch durch die elektrolytisch mit Platin
beschichteten Elektroden zur Explosion gebracht werden kann? (Das Gemisch würde sich beim Umkippen in diesem Bereich
ansammeln.)
Leider handelt es sich um einen Restposten, bei dem nachträglich die Kohleelektroden durch Platinelektroden ausgetauscht
wurden. Es gibt daher leider keinen Ansprechpartner, der sich mit diesem Aufbau experimentell beschäftigt hätte.
Haben Sie unabhängig von meinem Problem Erfahrungswerte, wann Wasserstoff / ein Knallgasgemisch durch Platin gezündet
werden kann? Im Hollemann-Wiberg (Lehrbuch der anorganischen Chemie) findet man auf der Seite 262 nur den Hinweis, dass
in dem Feuerzeug von Döbereiner Wasserstoff gegen fein verteiltes Platin strömte.
A: Wenn ich das richtig verstehe, sind die Elektroden - falls das System umfällt
- feucht. Dann geht keinerlei Gefahr von ihnen aus.
Beim Döbereiner-Feuerzeug oder bei den Perlkatalysatoren, Platinglaswolle usw. handelt es sich um feinstverteiltes Pt
mit großer Oberfläche. Aber auch hier muss man ab und zu aktivieren, das heißt, den Katalysator ausglühen. Platinnetze z. B.
reagieren nur, wenn man sie zuvor erwärmt hat. Bleche sind so inert, dass man eine davon ausgehende Gefahr zumindest in
Fällen wie dem Ihren vernachlässigen kann.
Anders ist es bei trockenen Elektroden, die frisch mit „Platinmohr“ überzogen sind. Darunter versteht man feinstes und
deshalb schwarzes, elektrolytisch abgeschiedenes Pt-Pulver. Solche Elektroden werden oftmals zu Leitfähigkeitsmessungen
herangezogen. Mit Leitfähigkeitszellen darf man auf keinen Fall elektrolysieren… Denn hier befinden sich die Elektroden
in so enger Nachbarschaft, dass es zu einer Entzündung des Knallgases kommen kann. Vor allem, weil es sich dabei auch um
ozonhaltigen Sauerstoff handeln kann.
1393
F: Betreff: Zitronensäurebatterie
Wir benötigen mal wieder Ihren Rat, weil keiner der Kollegen und Kolleginnen des Fachbereichs die Nuss knacken kann.
Wir haben 2 Zitronenbatterien in Reihe geschaltet und messen eine Spannung von 2 V sowie einen Strom von 20 mA. Warum
leuchtet die angschlossene LED (2V/20mA) nicht (Durchlassrichtung wurde beachtet)?
A: Wir haben mal eine LED (kurz für Light Emitting Diode, Lumineszenz-Diode)
benutzen wollen, um unser Modell einer Na/S-Batterie zu demonstrieren. Nichts ging - vor
allem nicht das einfache Anschließen mit Krokodilklemmen.
Dazu war schließlich ein gewaltiger Schaltkreis notwendig, den uns unsere Elektronik-Werkstatt gebaut hat. Dann
allerdings konnten wir auch eine LED mit einem Mikroampere-Strom betreiben.
Leider kann ich Ihnen da auch nicht weiterhelfen. Aber suchen Sie sich einen Elektrobastler. Vielleicht gibt’s den
sogar unter Ihren Schülern…
1394
F: Ich mache derzeit ein Praktikum an der im Lehrstuhl für Botanik an der Uni
Würzburg und wir möchten gerne den Einfluss des pH-Wertes auf die Diffusion von Aminosäuren (in diesem Fall Alanin)
durch die pflanzliche Kutikula untersuchen. Dazu benutzen wir den fotometrischen Nachweis mit Ninhydrin. Leider
fallen die Extinktionswerte in dem Pfuffer pH 9 sehr gering aus, bereits bei der Verdünnungsreihe für die Eichgerade.
Kann es sein, dass die Nachweisreaktion durch den hohen pH schlechter abläuft oder, dass Inhaltsstoffe des Puffers
(z.B. Borsäure) die Reaktion verhindern??
A: Die Bildung des Farbstoffs erfolgt am besten bei pH 6. Stellen Sie den
pH-Wert vor der fotometrischen Messung entsprechend ein.
1395
F: Wie (mit welcher appartatur) wird die Oberflächenspannung von Wasser und
Seifenlösung vergleichend gemessen?
A: Zur Messung der Oberflächenspannung einer Flüssigkeit benutzt man die
Bügelmethode.
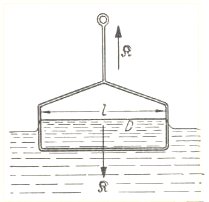
Dazu nimmt man einen Drahtbügel mit einem feinen, quergespannten Draht D mit der Länge l. Den Bügel hängt man samt Draht in die Flüssigkeit. Zieht man das Ganze heraus, so wird ein Flüssigkeitsfilm mit hochgezogen. Man zieht gerade so lange, wie die Flüssigkeit nicht abreißt. Die dazu aufzuwendende Kraft K wird mit einer Art Federwaage gemessen.
Die Oberflächenspannung ist s = K / 2 · l (Kraft/Länge). Sie wird auch wie folgt definiert: Energie/Fläche des herausgezogenen Flüssigkeitsfilms.