 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1396
F: Ich lebe in der Rhön, einem zum UNESCO-Biosphärenreservat ernannten
hessischen Mittelgebirge. Vergangenes Jahr wurde auf der Wasserkuppe der Ozonrichtwert von 120 Mikrogramm Ozon
pro Kubikmeter Luft 61 Mal überschritten. Laut Expertenmeinung in einem Zeitungsartikel sind daran vor allem
die Autofahrer im Rhein-Main-Gebiet schuld.
Nun soll in fünf Jahren mit dem Bau einer großen Bundesstraße durch die Rhön begonnen werden. Ich frage mich: Wird dadurch (abgesehen von der allgemeinen Luftverschmutzung) das Problem erhöhter Ozonwerte in unserer Gegend verstärkt? Oder sind die Autofahrer bei uns dann schuld an Ozonwarnungen weiter im Osten? Können Sie einem Laien wie mir erklären, wie sich Ozon am Boden ausbreitet? Zieht es mit dem Wind weiter und wie weit kann es sich ausbreiten?
A: Die konstant hohen Ozonwerte sind typisch für Reinluftgebiete. Der Grund:
Ozon bildet sich am Tag unter Licht- und UV-Strahlung, die auf Autoabgase einwirken. Dazu brauchen Sie nicht viele Autos
– es ist tatsächlich so, dass die Schadstoffe durch die vorherrschende Süd-Westströmung aus dem Rhein-Main-Gebiet zu
Ihnen kommen.
Wie kommt es zu Ihren hohen Ozonwerten? In den Städten sinkt nachts der Ozonwert wieder ab, weil die Abgase der weiterhin fahrenden Autos nun Ozon abbauen. Es fehlt schlichtweg das Sonnenlicht, um es wieder aufzubauen.
In Reinluftgebieten fehlt der nächtliche Autoverkehr. Deshalb kann das Ozon nicht abgebaut werden, sondern es wird am nächsten Tag auf erhöhtem Level neues hinzukommen. Dazu kommt, dass in der Höhenlage der Rhön die UV-Strahlung stärker ist. In den Städten mit dem Dunstschleier des Fotosmogs ist die UV-Strahlung dagegen schon stark abgeschwächt.
Wenn Sie also die neue Straße und damit erhöhten Autoverkehr bekommen, kann es sogar zur Folge haben, dass der Ozonlevel abnimmt! Aber das heißt nicht, dass die Luft deshalb besser wird…
Lesen Sie hierzu unsere Webseite.
1397
F: Die Strukturen der Häm- und Chlorophyll- und Vitamin B12-Moleküle sind ja
verblüffenden ähnlich. Ich finde es ist erwähnenswert, dass der Hämring auch in den Cytochromoxidasen und in Katalasen
enthalten ist: Zentralatom zT. Cu. Entwicklungsgeschichtlich alte Fische benutzen ihn mw. in ihrem Cu-Hämoglobin und
Paracoccus denitrificans schon in seiner Atmungskette. Man hat den Eindruck die Evolution hat die Erfindung dieses
genialen Moleküls einmal gemacht und für verschiedene Zwecke der Energiegewinnung eingesetzt ( das Vitamin B12-Molekül
Cyanocobalaminin fällt aus dieser Reihe vielleicht insofern etwas heraus ).- Hochkonservative Genregionen ?
Ich wüsste gerne, ob die Biosynthese dieser Moleküle auch ähnlich verläuft. Was, wenn zutreffend, für mich ein weiterer
Hinweis auf phylogenetische Zusammenhänge zwischen Tier und Pflanze wäre.
A: Die Verwandtschaft zwischen Mikroorganismen, Pflanzen und Tieren besteht außer
Zweifel. Es ist tatsächlich so, dass es für alle Organismen nur erstaunlich wenige zentrale Gene gibt, aus denen immer wieder
geschöpft wird. Die vielen Lebensformen sind oftmals nur geringe Variationen einiger dieser Gene. So ist der größte Teil des
Stoffwechsels der Hefezellen fast identisch mit dem unsrigen. Denken Sie daran, dass unser aktives Genom nach neuesten
Erkenntnissen nur etwa 10 000 Gene umfasst. (Ich habe in meinem Studium noch die Zahl 150.000 lernen müssen.)
Das Ringsystem, von dem Sie sprechen, beruht letztlich auf dem Porphin. Dieser recht stabile Heterocyclus wird von Lebewesen schon seit Urzeiten hergestellt, wie man aus Sedimentuntersuchungen weiß.
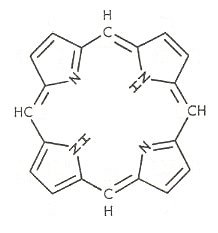
Strukturformel von Porphin
Diese Substanz wird sicherlich schon in der „Ursuppe“ vorhanden gewesen sein. Denn auch im Erdöl ist er reichlich zu finden. Das Leben hat damit immer herumexperimentiert. Die Synthese der Grundstruktur erfolgt überall nach ähnlichem Schema aus Aminolävulinsäure. Allerdings ist es als Chelatbildner erfolgreich mit verschiedensten Zentralatomen versehen worden (wie z. B. Co, Cu, V, Fe, Mg…). Auch die Substituenten am Ring können unterschiedlich sein. Ebenfalls sind die als Wirtsmoleküle dienenden Proteine, in die das System eingebaut wird, unterschiedlich.
Entsprechend verschieden ist die Aufgabenstellung. Einmal ist es der Sauerstofftransport (verschiedene Hämoglobin-Typen: Fe bei uns, V bei der Seescheide, Cu bei Krebsen…), die Sauerstoffspeicherung (Myoglobin), dann die Förderung von Redoxreaktionen (Cytochrome), der Abbau von Peroxiden (Katalase), der Elektronentransport (Cytochrome der Atmungskette), Umwandlung von Lichtenergie (Chlorophyll) und so weiter.
Im Rahmen dieser „Experimente“ ist dann auch das Vitamin B12 entstanden. Es ist gar nicht so verschieden von den anderen Verbindungen. Es hat zur Aufgabe, bei der Synthese einiger Aminosäuren bei der Kettenverzeeigung mitzuwirken.
1398
F: Meine Frage betrifft eher die Physik, vielleicht können Sie mir dennoch helfen.
Bei der Radiocarbonmethode zur Datierung von Fossilien misst man die Betastrahlung beim Zerfall von "14C".
14C hat im Atomkern 6 Protonen und 8 Neutronen, d. h. 2 zusätzliche Neutronen gegenüber 12C. Vom 14C zerfällt ein
Neutron in ein Proton und ein Elektron, woraus die Betastrahlung resultiert. Aus 14C wird 14N, denn der durch die
Umwandlung entstehende Atomkern hat nun 7 Neutronen und 7 Protonen.
Was aber ist mit der Elektronenhülle, die ja in der Summe 7 Elektronen für ein Stickstoffatom aufweisen muss? Das bei
der Umwandlung des Neutrons freiwerdende Elektron geht ja als Betastrahlung verloren.
A: Gute Frage. Aber das Elektron geht nicht verloren, weil keine elektrischen
Ladungen verloren gehen können.
Sie haben richtig gesagt, dass das 14N ein Proton mehr hat als das ursprüngliche 14C. Das kann man aus den Ordnungszahlen
der beiden Elemente herleiten (6 für C und 7 für N). Aus 14C wird also 14N+.
14C —> 14N+ + e-
Damit erhält das gesamte Atom eine positive Ladung. Formal wird das Elektron der Betastrahlung von der Schale des entstandenen 14N+ eingefangen.
14N+ + e- —> 14N
Sie dürfen nicht ins Grübeln kommen, weil man die Betastrahlung ja „misst“ und dabei scheinbar die Elektronen abzieht.
In diesem Fall holt sich das N+ das Elektron irgendwo anders her (zum Beispiel durch einen dem Zerfall anschließenden
chemischen Redoxprozess) – letztlich aber stimmt die Bilanz des gesamten Systems.
Hier haben wir auch ein Beispiel dafür, dass die physikalischen Kernprozesse oftmals dramatische chemische Auswirkungen
haben können! Bei dem Redoxprozess kann sich z. B. auch ein Radikal bilden.
1399
F: Leider muss ich Sie nochmal darum bitte mir eine Frage aus dem Alltag zu beantworten,
auf die ich mir einfach keinen Reim machen kann. Und zwar zum Thema: Schaum. Also wenn ich mein, etwas eingerostetes,
Chemiewissen abfrage, komm ich zu Folgendem:
Tenside haben einen hydophoben und einen hydrophilen Teil. Sind Tenside in der Lösung versuchen sie sich so anzuordnen,
dass möglichst wenig des hydrophoben Teils mit Wasser in Berührung kommt. Das ist der Grund warum sich Tenside an der
Wasseroberfläche anordnen und das führt doch letztlich auch zu Schaum oder?
Die Tenside bilden doch eine Doppelsicht. Also Luft, dann die wässrige Lösung und dann wieder Lust. Die hydrophoben
Teile der in der eingeschlossenen Sicht der wässrigen Lösung zeigen jeweils zur Lust.
Oh Gott, dass hab ich kompliziert geschrieben. Okay jetzt erst zur Frage: Wenn für Schaum Tenside so nötig gebraucht
werden, warum verschwindet dann der Schaum in der Wanne wenn ich anionische Tenside dazugebe? Erst dachte ich das hätte
was mit dem sehr harten Wasser bei uns zu tun, aber dann erinnerte ich mich daran, dass anionische Tenside auch in
Waschmitteln zur Schaumregulierung eingesetzt werden.
Wenn Tenside für Schaum verantwortlich sind, warum zerstören dann anionische Tenside den Schaum?
A: Sie haben alles richtig beschrieben – bis auf die Doppelschicht.
Auf der Wasseroberfläche bilden sich an der Grenze zur Luft die Teppiche der Tensidmoleküle. Diese sind stark
oberflächenaktiv, das heißt, sie schaffen sich gewaltsam Oberflächen. Deshalb zerlegen sie zum Beispiel Fettschichten
in viele kleine Fettkügelchen. Die haben mehr Oberfläche als die vorherige Fettschicht.
Wenn nun zu viele Tensidmoleküle da sind, müssen sie sich noch zusätzliche Oberflächen schaffen. Das machen sie,
indem sie Schaumblasen herstellen. (Weil das energieaufwendig ist und auch in endlicher Zeit ablaufen soll, muss der
außenvorstehende Betrachter natürlich rühren und kräftig schütteln…) Die Schaumwände besetzen die Tensidmoleküle dabei
von innen und von außen. Damit wird die Oberfläche verdoppelt. Dazwischen befindet sich – wenn überhaupt - ein feiner
Wasserfilm. Man kann den fließen sehen, wenn man Seifenblasen im Licht betrachtet.
Es ist sogar möglich, dass sich die Tensidmoleküle in der Schaumblasenwand so nahe kommen, dass sich ihre hydrophilen Reste annähern, dass sie also quasi Schwanz an Schwanz stehen. Die binden sich untereinander aufgrund van der Waalscher Bindungen. Sie müssen sich nicht an die Luftmoleküle (ebenfalls durch vdW) binden – wie es bei „normaler“ Tensidwirkung ohne Schaumbildung der Fall ist. Das resultierende Gebilde ist die molekulare Doppelschicht. Die ist auch typisch für den Aufbau biologischer Membranen.
Natürlich ist Schaum nicht ewig stabil. Das erkennen Sie daran, dass die Wasserschicht einer Blase einfach mit der Schwerkraft zerfließt. Dass anionische Tenside den Schaum zerstören, ist mir neu. Haben Sie schon einmal Seifenblasen gemacht? Die sind die „anionischten“ Tenside überhaupt…
Sie sollten übrigens – wie in Ihrem Schreiben - nicht immer Luft mit Lust verwechseln…
1400
F: Mein Problem dreht sich um Schwefel. Ich habe Ihre Seite schon ausgiebig
studiert und auch sonst viel gegoogelt aber leider nichts zu meiner Problemstellung gefunden.
Und zwar war ich die letzten 8 Monate in Chile zu einem Auslandssemester. Zeit zu reisen hatte ich auch genug und
so verschlug es mich auch in die Atacama Wüste im Norden. Während einer Jeeptour hielten wir an einer Lagune. Gespeist
wurde diese sie durch heisse Quellen die man auch als natürliches Thermalbad benutzen konnte. Wir liessen uns diese
Möglichkeit auf ein heisses Bad natürlich nicht entgehen. Das Wasser war wohl stark schwefelhaltig. Jedenfalls roch
es so und auch der Schlamm am Grund hatte einen starken Schwefelgeruch.
Von der Haut ging alles 2 Tage später unter einer Dusche (zurück in der Zivilisation) gut ab. Die Badehose habe ich
aber dummerweise mit ein paar TShirts gewaschen und diese riechen seit dem sehr stark nach Schwefel. In der Sonne und
nach ein paar Stunden tragen besonders. Ebenso nach dem Trockner.
In der Reinigung haben sie mir schon gesagt, dass da wohl nichts zu machen ist aber ich würde da gerne ein bisschen
experementieren. Da müsste doch was zu machen sein?!Es sind nämlich auch ein paar Lieblings-T-Shirts dabei.
Vielleicht haben Sie ja einen Tipp?
A: Ich weiß nicht, was Sie mit Schwefelgeruch meinen: Schwefelwasserstoff (->
Geruch nach faulen Eiern) oder Schwefeldioxid (-> Stechender Geruch nach brennendem Schwefel).
Auf jeden Fall müsste eine Behandlung mit einem Vollwaschmittel (ohne Farbschutz) ausreichen. Denn beide Schwefelsubstanzen
sind oxidierbar. In Vollwaschmitteln sind Oxidationsmittel enthalten. Sie sollten die Stücke aber nicht allzu lange in der
Waschlauge belassen, da diese die Farben angreifen kann.
Sie können alternativ auch eine stark verdünnte, schwach alkalische („sodaalkalische“) Lösung von Wasserstoffperoxid
verwenden. Danach gut ausspülen. Eventuell müssen Sie die Prozedur wiederholen. Probieren Sie vorher aus, ob Ihr Lieblingsshirt
das Oxidationsmittel aushält.