 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1466
F: Was ist Leuchtöl? Das leuchtet doch wohl nicht?
A: Nein, es leuchtet natürlich nicht (auch wenn frisches Erdöl durchaus stark
fluoreszieren kann). Die Bezeichnung Leuchtöl bezieht sich auf dessen Verwendung in Lampen. Es handelt sich um ein Gemisch
von Kohlenwasserstoffen mit einem mittleren Siedebereich, der zwischen denen von Benzin und Dieselöl liegt. Man bezeichnet
das Gemisch auch als Petroleum oder Kerosin.
Die Verwendung von Erdöldestillaten zu Leuchtzwecken war 1854 auch der Grund für den Start der Erdölproduktion in den USA. Das erwartete Produkt nannte man Leuchtpetroleum oder Naphtha. Bis dahin nutzte man vor allem tierische und pflanzliche Fette und Öle als Lampenöle oder Leuchtstoffe.
Übrigens gab es früher auch das Leuchtgas. Dieses „Stadtgas“ wurde zunächst nur zum Betreiben von Gaslampen eingesetzt. Es war zunächst nichts anderes als das bei der Verkokung von Kohle anfallende Gemisch von CO und Methan (und einigen anderen gasförmigen Kohlenwasserstoffen). Man vermischte es noch mit Wassergas (erhalten aus der Reaktion zwischen Wasserdampf und glühender Kohle), wodurch es mit Wasserstoff angereichert und sein Heizwert gesteigert wurde.
1467
F: Ich bin Referendarin an einer Grundschule und besuche regelmäßig ihre Seite, um mir
Anregungen für Versuche im Unterricht zu holen. Das ist wirklich ein tolles Angebot, großes Lob!
Für meine Abschlussprüfung möchte ich im Rahmen des Themas "Ernährung" Lebensmittel untersuchen. In vielen der online
präsentierten Unterrichtsreihen werden dazu Teststreifen für unterschiedliche Nachweise verwendet (Glucosestäbchen...).
Haben Sie diesbezüglich vielleicht einen Tipp, wo ich diese Materialien günstig beziehen kann? Ich habe bereits diverse
Chemie-Großkonzerne bzw. Apothekenlieferanten angeschrieben, da Apotheken selbst meist ziemlich hohe Preise haben. Aber richtig
weiterhelfen konnte mir noch niemand....
A: Fragen Sie doch bei den Apotheken nach, ob die abgelaufene Produkte haben oder
Ihnen beschaffen können. Ansonsten fragen Sie den Förderverein Ihrer Schule. Die Eltern machen manchmal Geld locker, wenn es
sich um die naturwissenschaftliche Bildung ihrer Kinder handelt.
Dann gibt es noch den Fonds der Chemie. Die haben verlauten lassen, dass sie auch Grundschulen fördern. Sprechen Sie dazu
den Verband der Chemischen Industrie an: http://fonds.vci.de.
1468
F: Gibt es einen Zusammenhang zwischen der Bindungsenergie pro Gitterbaustein (Atom/Ion)
und der Schmelztemperatur eines Kristalls?
Die Schmelztemperatur müsste doch eigentlich von der Bindungsenergie abhängen. Nun habe ich gefunden, dass die Bindungsenergie
pro Gitterbaustein je nach Bindungsart einige meV bis einige eV betragen kann. 1eV entspricht etwa einer Temperatur von 10000K?
Dann müssten sich aber Schmelztemperaturen im Bereich von 10000K ergeben, das ist aber bekanntlich nicht der Fall. Selbst die
Siedetemperaturen der Materialien liegen deutlich unter diesem Wert.
Wo ist mein Fehler?
A: Ihre Temperatur/Energie-Vergleiche stammen aus der kinetischen Gastheorie und sind
hier nicht anzuwenden. Sie denken sicherlich an E = k • T = ½ mv2 und so weiter.
Es gibt keinen direkten Zusammenhang zwischen molarer Bindungsenergie (besser: Bindungsenthalpie) und dem Schmelzpunkt. Es ist zwar richtig, dass der Schmelzpunkt von der Energie der beteiligten Bindungen abhängt – aber nicht so direkt, wie Sie meinen. Was man beobachtet, ist die Umwandlung von außen zugeführter Schmelzenthalpie, also der negativen Kristallisationsenthalpie.
Sie könnten sich ja mal eine Art Haber-Bornschen Kreisprozess für den Schmelzvorgang aufstellen. Dazu müssen Sie sich den Schmelzvorgang genau ansehen. Hier geht es nicht nur um Spaltung von Bindungen. Ein nicht unbeträchtlicher Teil der Schmelzenthalpie wird gebraucht, um das Gitter zunächst einmal zum Schwingen zu bringen. Von der Schwingungsfähigkeit der Teilchen hängt es ab, wie leicht die intermolekularen Wechselwirkungen überwunden werden können. Deshalb spielt auch die Molmasse der das Kristallgitter aufbauenden Teilchen eine wichtige Rolle. Dann müssen endlich die Bindungen gelöst werden; hier kommt endlich die von Ihnen angesprochene Bindungsenergie ins Spiel. Ein anderer Teil der Schmelzenthalpie wird in kinetische Energie umgewandelt, um die Teilchen in der Schmelze räumlich zu trennen.
1469
F: Ich habe eine Hausaufgabe: Bei der Dehydratisierung (Abspaltung von Wasser in Alkohole
durch einen Katalysator) von 3-Methyl-3-hexanol können sich verschiedene Alkene bilden. Geben Sie die möglichen Strukturformeln an,
und benennen Sie die entsprechende Verbindungen. Können Sie helfen?
A: Es gibt bei dieser Eliminierungsreaktion drei Produkte: 3-Methyl-hexen-2 (Struktur 1),
3-Methyl-hexen-3 (Struktur 2) und 3-Methylen-hexan (Struktur 3). Die cis/trans-Isomere habe ich dabei nicht berücksichtigt.
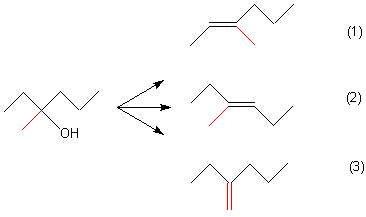
Wessen Bildung wird bevorzugt? Das ist das 3-Methyl-hexen-3. Dahinter steckt die Regel von Saytzeff: Man erhält bei Eliminierungen überwiegend das an der Doppelbindung stärker verzweigte isomere Alken, hier also das 3-Methyl-hexen-3. Der Grund ist der +I-Effekt der Alkylgruppen.
Als Merkhilfe kann man es auch biblisch formulieren: Wer wenig hat, dem wird genommen werden.
Nimmt man Zeolithe als Katalysatoren und erwärmt man, können sich noch weitere ungesättigte Abbauprodukte bilden. Dabei wird aber auch das Kohlenstoffgerüst im Sinne des Crackings angegriffen.
1470
F: Wie groß ist ein Würfel aus Aluminium, der eine Tonne wiegt? Da die Dichte von Aluminium
2,7 g/cm3 ist, also 2,7-mal so groß wie die von Wasser, muss der Würfel doch nur etwa 1/3 so groß sein wie ein Würfel
aus einer Tonne Wasser. Dessen Kantenlänge beträgt ja 1 m.
A: Wenn Sie das Volumen meinen, stimmt es. Aber bei den Kantenlängen ist es ganz anders.
Die Dichte des Aluminiums ist 2,7 g/cm3 oder 2,7 t/m3. Das Volumen ist
V (1 Tonne) = 1 t / 2,7 t/m3 = 0,370 m3
Die Kantenlänge ist die dritte Wurzel aus dem Volumen:
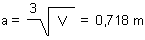
Wir lernen daraus wieder einmal, dass wir uns schwertun bei der Beurteilung von Potenzzahlen.